MENU
酸素の単体と化合物の性質・製法
目次
はじめに
【プロ講師解説】このページでは『酸素の単体と化合物の性質・製法』について解説しています。
酸素の単体
- 酸素の単体には酸素やオゾンなどの同素体が存在する。
- これらの性質について、次の表にまとめる。
| 酸素 | オゾン | |
|---|---|---|
| 化学式 | O2 | O3 |
| 構造 |   | 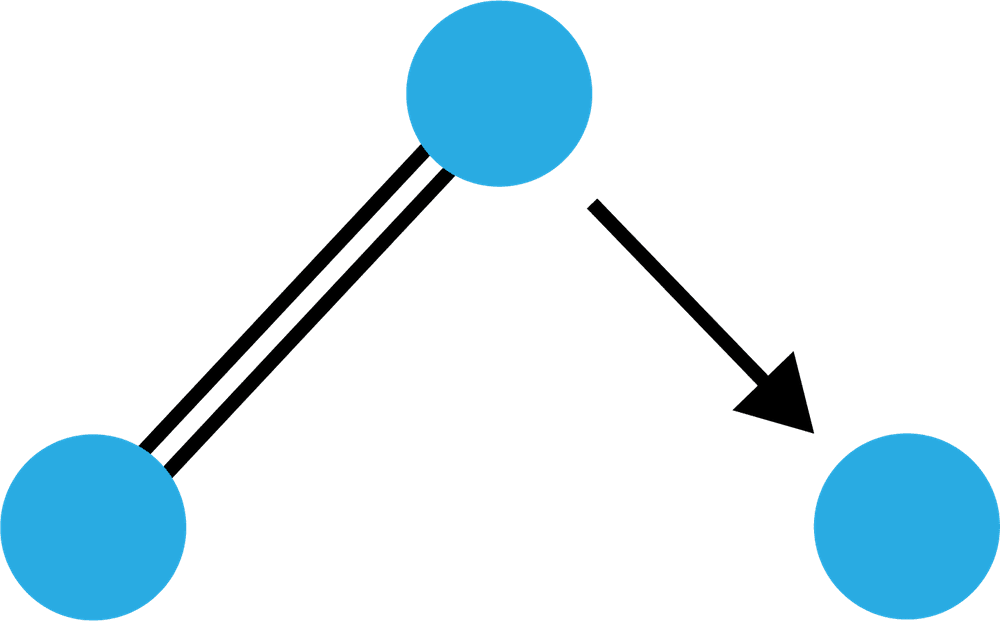  |
| 色 | 無色 | 淡青色 |
| におい | 無臭 | 特異臭 |
| 酸化力 | あり | あり |
| 製法 | 酸化物の分解 液体空気の分留 | 酸素の無声放電 酸素への紫外線照射 |
| その他性質 | 助燃性あり | 紫外線を吸収する |
酸素O2
- 酸素O2は酸素O原子2個が二重結合してできた分子である。
- O2の特徴は、次の通りである。
●酸素O2の特徴
- 無色/無臭
- 【実験室的製法】H2O2やKClO3などの酸化物を熱分解する(触媒:二酸化マンガンMnO2)
- 【工業的製法】液体空気の分留
❶ 無色/無臭
- O2は常温・常圧時、無色・無臭の気体である。
❷ 【実験室的製法】H2O2やKClO3などの酸化物を熱分解する(触媒:二酸化マンガンMnO2)
- O2はH2O2やKClO3などの酸化物を、触媒としてMnO2を用いて熱分解することで得られる。
\[
\mathrm{2H_{2}O_{2} → 2H_{2}O + O_{2}}\\
\mathrm{2KClO_{3} → 2KCl + 3O_{2}}
\]
❸ 【工業的製法】液体空気の分留
- O2は液体空気の分留により得られる。
クラーク数
- 地球から10マイル(約16km)までの範囲における元素の存在率(質量パーセント濃度)をクラーク数という。
- クラーク数を一覧で示すと次のようになる。
| 元素 | クラーク数 |
|---|---|
| O | 49.5 |
| Si | 25.8 |
| Al | 7.56 |
| Fe | 4.70 |
| Ca | 3.39 |
| Na | 2.63 |
| K | 2.40 |
| Mg | 1.93 |
| H | 0.87 |
| Cl | 0.19 |
- クラーク数が最も大きい元素は酸素Oであることが確認できる。
クラーク数上位5つの元素(O・Si・Fe・Ca・Na)は『おっしゃってるかな』のゴロで覚えましょう。
オゾンO3
- 酸素分子O2に1つのO原子が配位結合した物質をオゾンO3という。
構造
- O3の特徴は、次の通りである。
●オゾンO3の特徴
- 淡青色/特異臭/有毒
- 酸化剤
- 【実験室的製法】酸素O2の無声放電または紫外線照射
❶ 淡青色/特異臭/有毒
- O3は淡青色/特異臭/有毒の気体である。
❷ 酸化剤
- O3は酸化・還元反応において、酸化剤としてはたらく。
\[
\mathrm{O_{3}+2H^{+}+2e^{-}→O_{2}+H_{2}O}
\]
❸ 【実験室的製法】酸素O2の無声放電または紫外線照射
- O3は酸素の無声放電(高電圧の放電)または紫外線照射を行うことで得られる。
\[
\mathrm{3O_{2} → 2O_{3}}
\]
無声放電とは
- 酸素に直接高電圧をかけると、音や光を伴う激しい放電が起こる。
- 対して、ガラス管を隔てた2本の電線に高電圧をかけると、絶縁体であるガラス管により、音や火花を伴わない穏やかな放電が起こる。このような放電を無声放電という。
オゾン層
- オゾン層破壊に関する問題は、世界中で議論されている。
オゾンの生成と分解
- 大気中のオゾンO3は主に成層圏(地上から約10〜50km上空)に存在し、このようなO3の多い層をオゾン層という。
- 成層圏において、酸素O2は太陽からの紫外線を吸収して酸素O原子に分解する。このO原子は他のOと結合し、O3が生成する。
- O3は紫外線を吸収して分解し、O2に戻る。
- このように、オゾンと酸素の関係により、オゾン層のオゾン濃度は一定に保たれており、生物に有害な紫外線が地上に降り注ぐのを防いでいる。
フロンによるオゾン層破壊
- 炭化水素(リンク)の水素H原子を、フッ素F原子や塩素Cl原子で置換した化合物をフロンという。
- フロンはエアコンや冷蔵庫の冷却に使われてきたが、近年このフロンがオゾン層を破壊していることがわかってきた。
- フロンは化学的に安定であり、長い年月をかけて成層圏のオゾン層まで拡散する。
- フロンはオゾン層で紫外線により分解し、Cl原子を生じる。
※フロンにはいくつか種類が存在する。ここでは代表的なフロンとしてジクロロジフルオロメタンCCl2F2を例とする。
\[ \mathrm{CCl_{2}F_{2}→CClF_{2}+Cl} \]
- Cl原子は不対電子(リンク)をもち、次のような流れでO3を破壊する。
\[ \mathrm{Cl+O_{3}→ClO+O_{2}}\\
\mathrm{ClO+O→Cl+O_{2}}
\]
- 上の式で使われたCl原子が、下の式で再生している。したがって、この再生したCl原子が再びO3を分解するため、この反応は連鎖的に起き、オゾン層の破壊が進む。
酸化物
- 物質が酸素と化合することを酸化、酸化した化合物を酸化物という。
- 酸化物については次のページを参照のこと。
酸素の水素化物
- 酸素の水素化物としては、水H2Oと過酸化水素H2O2がある。
- それぞれの化学式、構造、特徴は次の通りである。
| 水 | 過酸化水素 | |
|---|---|---|
| 化学式 | H2O | H2O2 |
| 構造 | 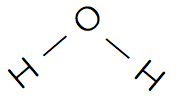  | 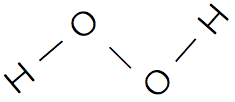 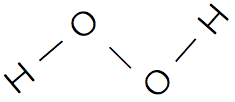 |
| 特徴 | 沸点が高い | 酸化還元反応において酸化剤としても還元剤としても働く |
水H2O
- H2Oは分子間で水素結合を形成するため、分子間の繋がりがなかなか切れないので、沸点・融点が高いのが特徴的である。
過酸化水素H2O2
\[
\mathrm{酸化剤: H_{2}O_{2} + 2H^{+} + 2e^{-} → 2H_{2}O}\\
\mathrm{還元剤: H_{2}O_{2} → O_{2} + 2H^{+} + 2e^{-}}
\]
過酸化物
- 過酸化水素H2O2のように、酸素O原子2つによる結合(-O-O-)をもつ化合物を過酸化物という。
- 過酸化物は、不安定で分解しやすい。
例)H2O2の分解(触媒として酸化マンガン(Ⅳ)MnO4を用いる)
\[ \mathrm{2H_{2}O_{2}→2H_{2}O+O_{2}} \]
- これは、-O-O-を形成する2つのO原子の非共有電子対が反発し、結合エネルギーが小さくなっている(結合が切れやすい)のが原因である。











