MENU
【化学平衡】平衡定数やmol数の変化、グラフなど
はじめに
【プロ講師解説】このページでは『【化学平衡】平衡定数やmol数の変化、グラフなど』について解説しています。
化学平衡とは
- 化学平衡について、水素とヨウ素の反応を例に解説する。
\[ \mathrm{H_{2}+I_{2}\underset{逆反応}{\overset{正反応}{\rightleftarrows}}2HI} \]
- まずは、正反応の方に注目する。反応速度の式(V=K[A])より、反応物の濃度([A])が大きいと反応速度(V)も大きくなる。正反応における反応物はH2とI2なので、反応速度は最初が最も大きく、徐々に(反応物であるH2とI2の濃度が減少していくので)小さくなっていく。
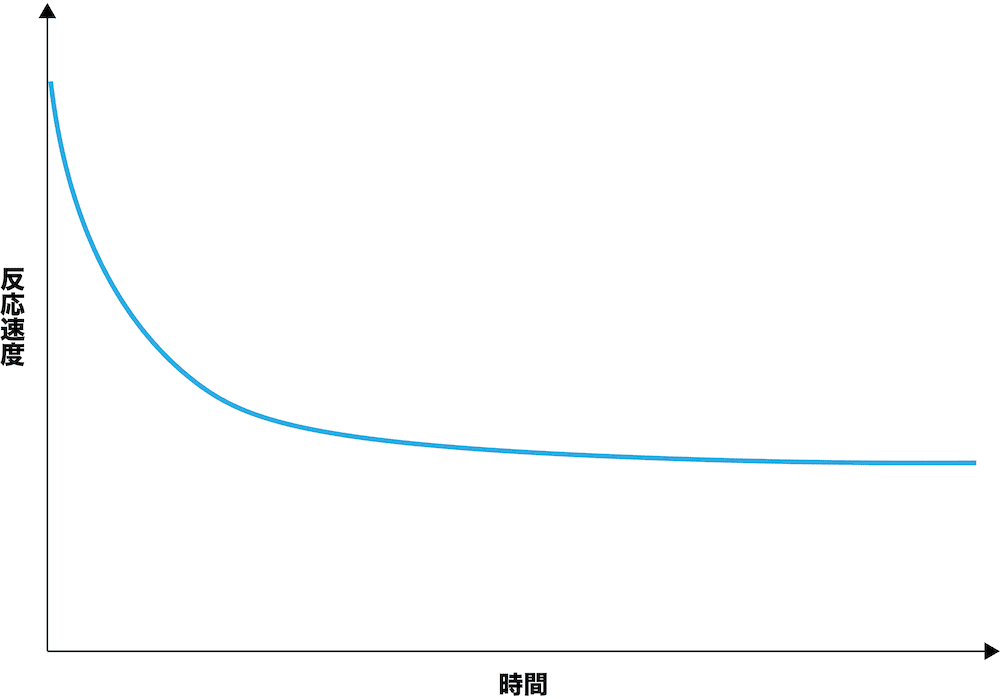

- 一方、逆反応はHIからH2とI2が生成する反応なので、反応物はHIである。
\[ \underbrace{ \mathrm{2HI} }
_{ \text{ 反応物 }}→\underbrace{ \mathrm{H_{2}+I_{2}} }
_{ \text{ 生成物 }} \]
- 始めはHIの濃度が極めて低いので、反応速度の式(V=K[A])から分かるように反応速度は非常に小さい。徐々にHIの濃度が増加していくと、それに伴って反応速度も大きくなっていく。
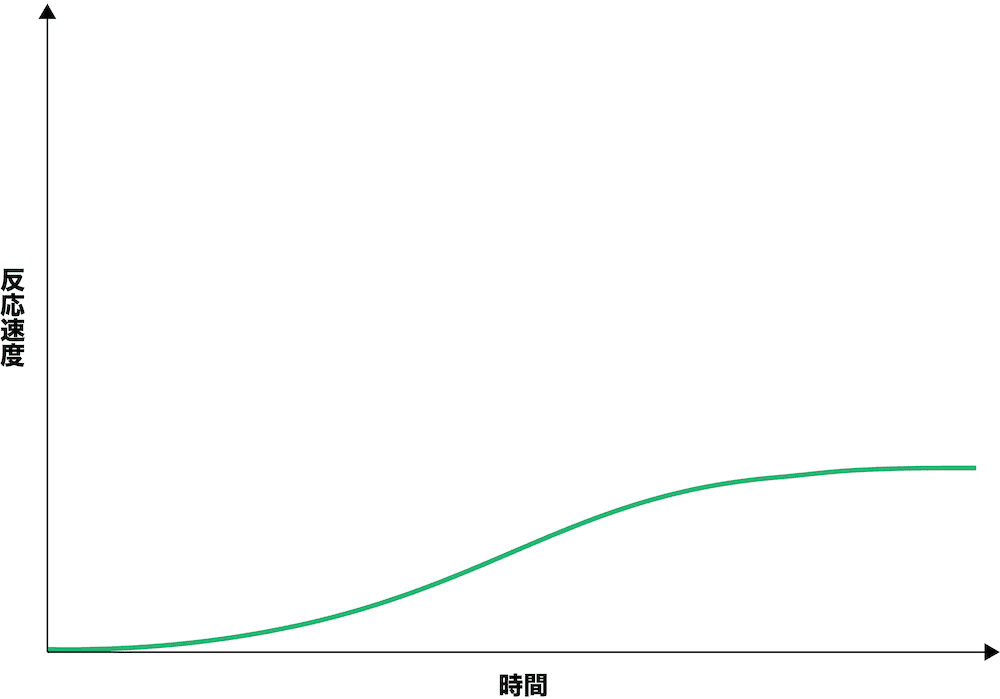
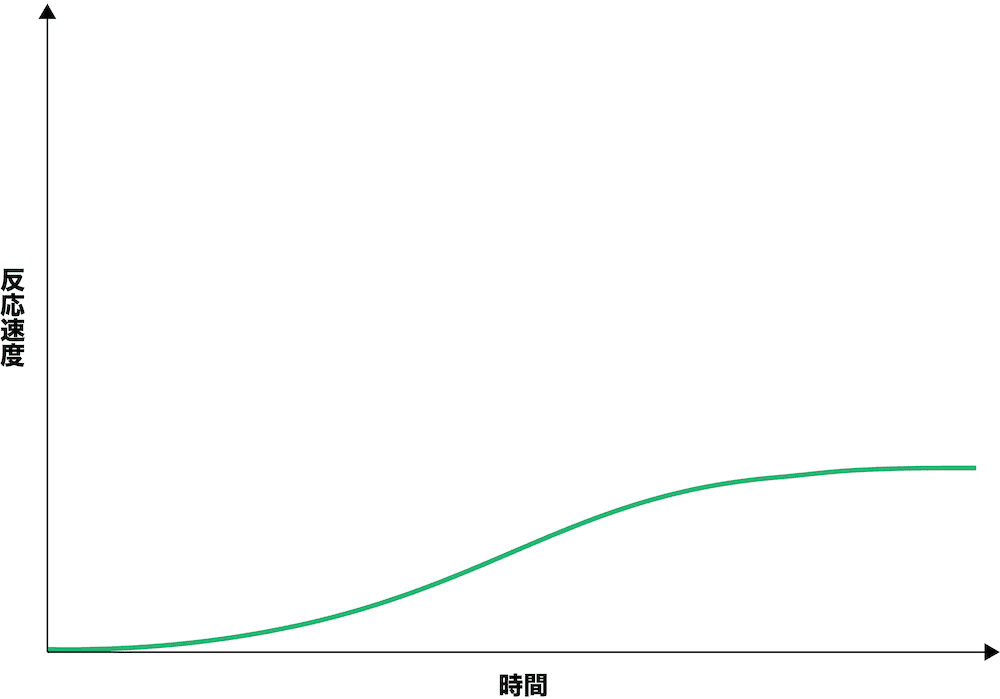
- 以上のように、正反応の速度は次第に小さく、逆反応の速度は次第に大きくなっていくが、両方とも最終的には同じ速度に落ち着き一定となる。
- この正反応と逆反応の速度が等しくなった状態を平衡状態という。
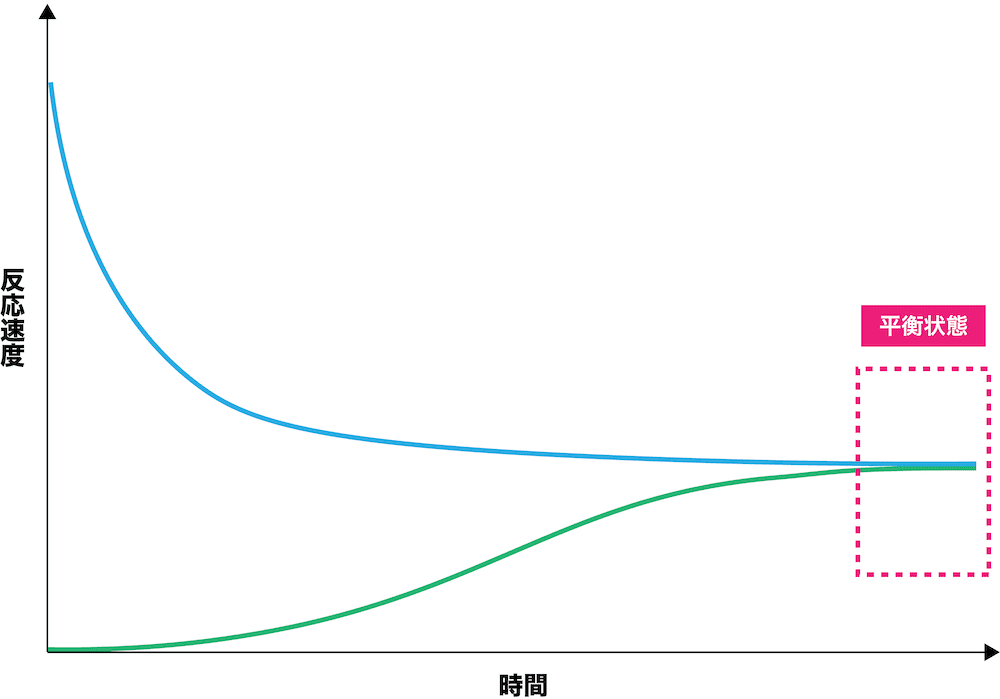



- 平衡状態になると、一見反応が止まっているようにみえる。しかし実際は、「正反応と逆反応が起こっているが、2つの速度が等しいため反応が進んでないように見えるだけ」だということを把握しておこう。
化学平衡とmol数の変化
- 化学平衡とmol数の変化の関係について、先ほどの反応を例に解説する。
\[ \mathrm{H_{2}+I_{2}\underset{逆反応}{\overset{正反応}{\rightleftarrows}}2HI} \]
- 反応前のH2とI2のmol数が1.0、平衡時は0.20だとすると、次のように考えることができる。



- 反応で使われたH2とI2は0.80mol(1.0ー0.20)ずつなので、係数比より生成したHIは1.6molであることがわかる。
- このとき、縦軸にmol数、横軸に時間をとったグラフは次のようになる。
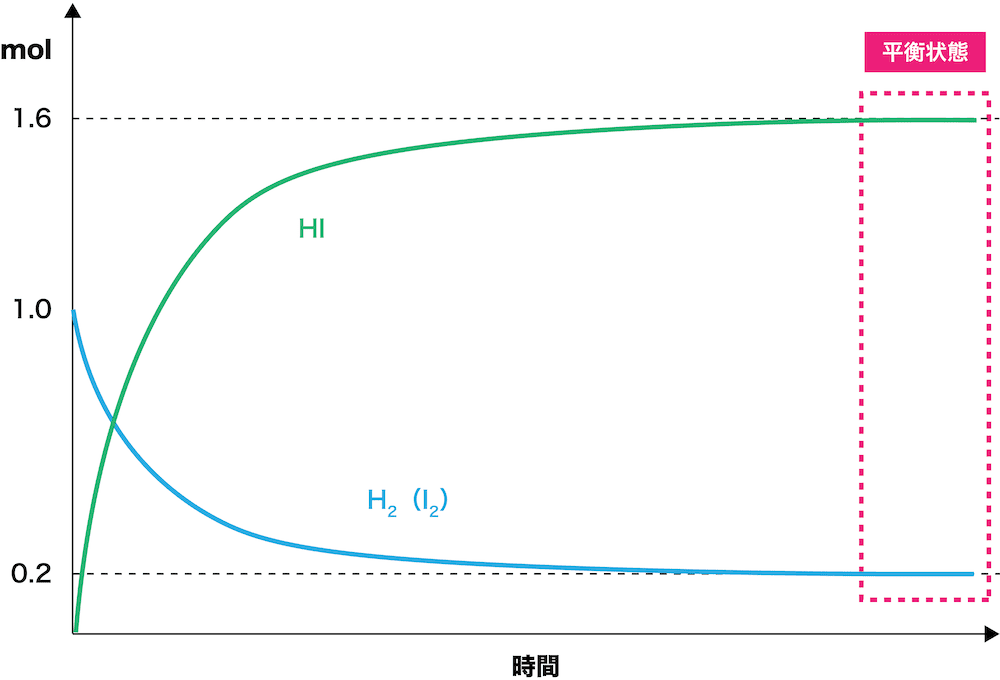

- H2とI2は、最初1.0molあったのが平衡時には0.20molに、HIはスタート時は0molだったのが平衡時には1.6molになっている。
- 上で紹介した反応速度のグラフは最終的に2つのグラフが重なっていたが、こちらは必ずしも重なるわけではないため注意しよう。(重なるのは、生成物と反応物の平衡時のmol数が一緒だった場合)
平衡定数K
\[ \mathrm{H_{2}+I_{2}⇄2HI} \]
- この反応が平衡状態のとき、H2、I2、HIのモル濃度をそれぞれ[H2]、[I2]、[HI]とすると次の関係式が成り立つ。
\[ K=\frac{ \mathrm{[HI]^{2}} }{ \mathrm{[H_{2}][I_{2}]} } \]
- このKを平衡定数という。[HI]に2乗が付いているが、これは反応式中のHIの係数からきている。平衡定数を求める式では、濃度を反応式中での係数乗する。
- また、平衡定数Kに関して1つ知っておくべきことがある。
平衡定数Kは、温度のみに依存する
- 平衡定数は「温度変化のみ」に影響されて変化する。反対に考えると、温度が一定であればスタート時のmol数などが違っても平衡定数Kは一定となる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
正反応の速度は次第に【1(大き or 小さ)】く、逆反応の速度は次第に【2(大き or 小さ)】くなっていくが、両方とも最終的には同じ速度に落ち着き一定となる。この、正反応と逆反応の速度が等しくなった状態を【3】という。
解答/解説:タップで表示
解答:【1】小さ【2】大き【3】平衡状態
正反応の速度は次第に小さく、逆反応の速度は次第に大きくなっていくが、両方とも最終的には同じ速度に落ち着き一定となる。
この正反応と逆反応の速度が等しくなった状態を平衡状態という。




平衡状態になると一見反応が止まっているように見えるが、実際は【1】反応と【2】反応が起こっており、2つの速度が【3(等しい or 異なる)】ため反応が進んでないように見えるだけである。
解答/解説:タップで表示
解答:【1】正【2】逆【3】等しい(【1】・【2】は順不同)
平衡状態になると、一見反応が止まっているようにみえる。しかし実際は、「正反応と逆反応が起こっているが、2つの速度が等しいため反応が進んでないように見えるだけ」だということを把握しておこう。




「H2 + I2 ⇆ 2HI」の反応において、反応前のH2とI2のmol数が1.0、平衡時は0.20だとすると、平衡時のHIの物質量は【1】molである。
解答/解説:タップで表示
解答:【1】1.6
反応前のH2とI2のmol数が1.0、平衡時は0.20だとすると、次のように考えることができる。



反応で使われたH2とI2は0.80mol(1.0ー0.20)ずつなので、係数比より生成したHIは1.6molであることがわかる。
平衡状態では、温度が一定であれば平衡定数Kの値は一定となる。これを【1】の法則という。
解答/解説:タップで表示
解答:【1】化学平衡(質量作用)
平衡状態では、温度が一定であれば平衡定数Kの値は一定となる。これを化学平衡(質量作用)の法則という。
平衡状態において一定となる定数を【1】という。
解答/解説:タップで表示
解答:【1】平衡定数
化学反応式「aA + bB ⇆ cC + dD」の平衡定数Kは、次のように表すことができる。
\[ K = \frac{\mathrm{[C]}^{c}\mathrm{[D]}^{d} }{\mathrm{[A]}^{a}\mathrm{[B]}^{b} } = 一定 \]
平衡定数は【1】に依存する。
解答/解説:タップで表示
解答:【1】温度
平衡定数は温度に依存する。
気体反応の場合、モル濃度ではなく各気体の分圧で平衡定数を考える場合がある。この平衡定数を【1】といい、記号【2】で表す。
解答/解説:タップで表示
解答:【1】圧平衡定数【2】Kp
気体反応の場合、モル濃度ではなく各気体の分圧で平衡定数を考える場合がある。これを圧平衡定数といい、Kpと表す。
化学反応式「aA + bB ⇆ cC + dD」の圧平衡定数Kpは、気体Aの圧力をPA、気体Bの圧力をPBとすると次のように表すことができる。
\[ K_{p} = \frac{ P_{\mathrm{C}}^{c}×P_{\mathrm{D}}^{d} }{ P_{\mathrm{A}}^{a}×P_{\mathrm{B}}^{b} } = 一定 \]











