MENU
アルコール・エーテル(一覧・違い・命名法・製法・反応・性質など)
はじめに
【プロ講師解説】このページでは『アルコール・エーテル(一覧・違い・命名法・製法・反応・性質など)』について解説しています。
アルコールとは
- 炭化水素のHをヒドロキシ基-OHで置換した化合物をアルコールという。

アルコール一覧
- 代表的なアルコールを次に示す。
| 価数 | 名称 | 構造式 |
|---|---|---|
| 1 | メタノール | CH3OH |
| エタノール | CH3CH2OH | |
| 1-プロパノール | CH3CH2CH2OH | |
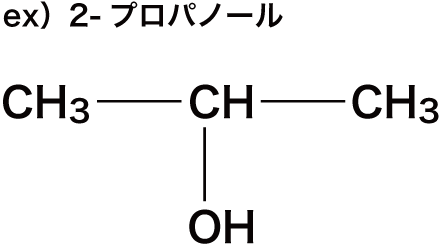
| 2-プロパノール | 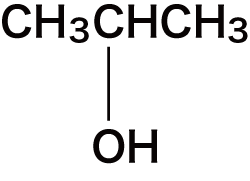  | |
| 2 | エチレングリコール(慣用名) | HO-CH2-CH2-OH |
| 3 | グリセリン(慣用名) | 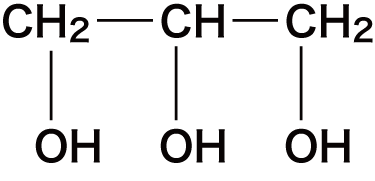  |
アルコールの命名法
- アルコールの命名は次の手順で行う。
●STEP1
主鎖の炭素数を数え、ベースとなるアルカン名を決定する。
●STEP2
アルカン名の語尾を「アン(ane)」から「オール(ol)」にかえ、先頭にヒドロキシ基が付いている炭素の番号を書く。
●STEP3
ヒドロキシ基の他に官能基が付いている場合は、官能基名と官能基が付いている炭素の番号をアルカン名の前に書く。
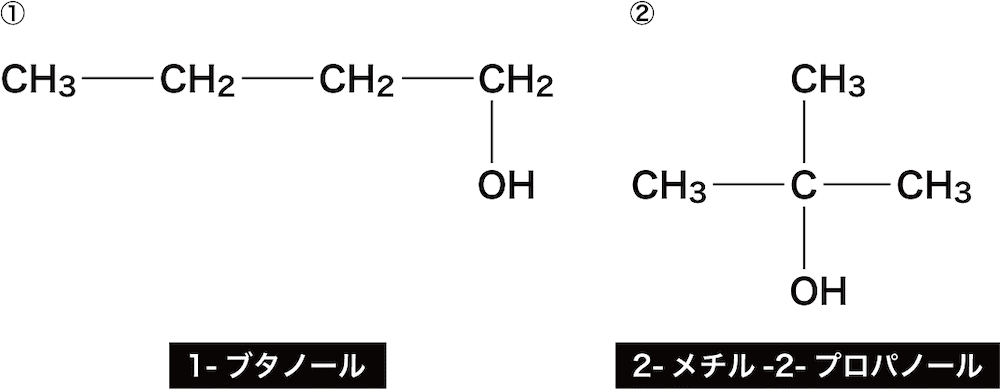
- ここでは次のアルコールを例に命名の手順を確認する。
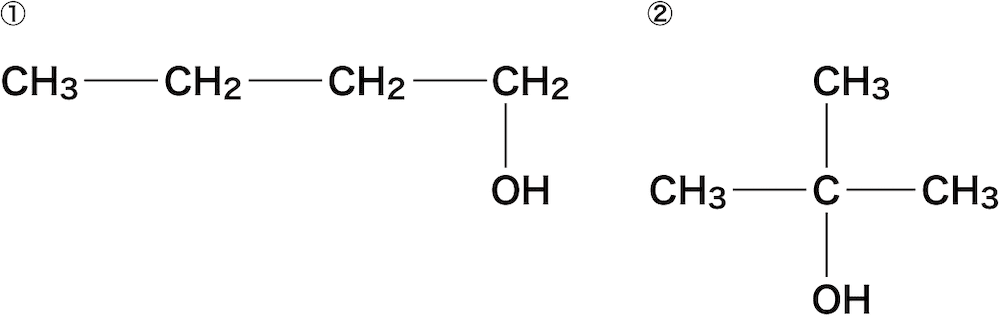

まずは、主鎖の炭素数を数え、ベースとなるアルカン名を決定する。
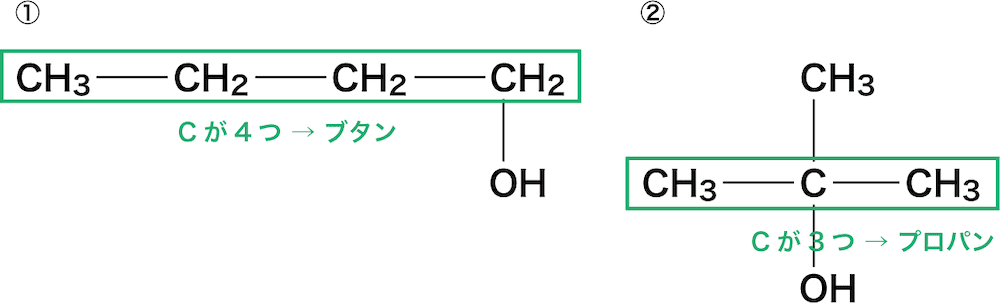

①は主鎖の炭素数が4つのためブタン、②は3つのためプロパンである。
次に、アルカン名の語尾を「アン(ane)」から「オール(ol)」にかえ、先頭にヒドロキシ基が付いている炭素の番号を書く。
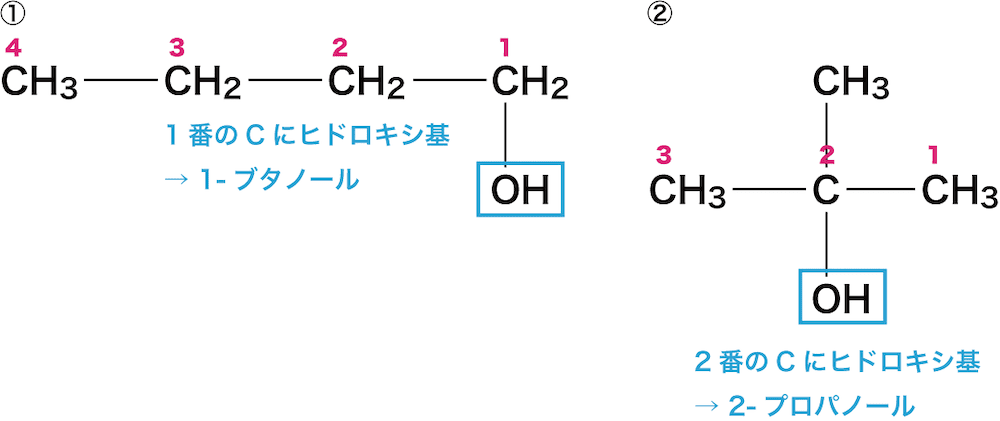

①は1番の炭素にOHが付いているため「1-ブタノール」、②は2番の炭素にOHが付いているため「2-プロパノール」となる。
ちなみに、①はヒドロキシ基以外の官能基がないので次の3STEPをする必要がなく、ここで完成となる。
最後に、ヒドロキシ基の他に官能基が付いている場合は、官能基名と官能基が付いている炭素の番号をアルカン名の前に書く。
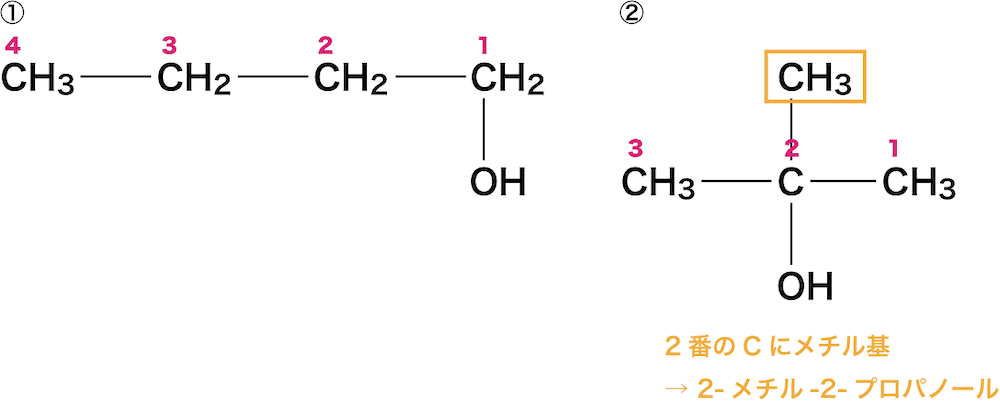

先ほど述べたように、①はヒドロキシ基以外の官能基が付いていないためもう何もする必要がない。
②は2番目の炭素にメチル基が付いているためSTEP2でつくった「2-プロパノール」の名称の前に「2-メチル」を付けて「2-メチル-2-プロパノール」とする。

アルコールの性質
●アルコールの性質
- C1〜C3くらいまでだと水によく溶ける。
- (異性体のエーテルと比べて)沸点が高い。
❶ C1〜C3くらいまでだと水によく溶ける。
- アルコールは親水基(水と親和性が高い官能基)であるヒドロキシ基(-OH)をもつため、炭素数が1個〜3個くらいだと、水によく溶ける。
- 一方、炭素数が多いと炭素に対する親水基の割合が下がり溶けづらくなる。
❷ (異性体のエーテルと比べて)沸点が高い。
- アルコールはヒドロキシ基(-OH)をもつ。このヒドロキシ基のOと、近くのアルコールがもつヒドロキシ基のHが水素結合を形成することにより、分子間の結合が強固になっている。
- 一方、アルコールの異性体であるエーテルは、ヒドロキシ基をもたず、水素結合を形成することができない。
- したがって、アルコールの沸点は、同炭素数のエーテルの沸点と比較して高い。
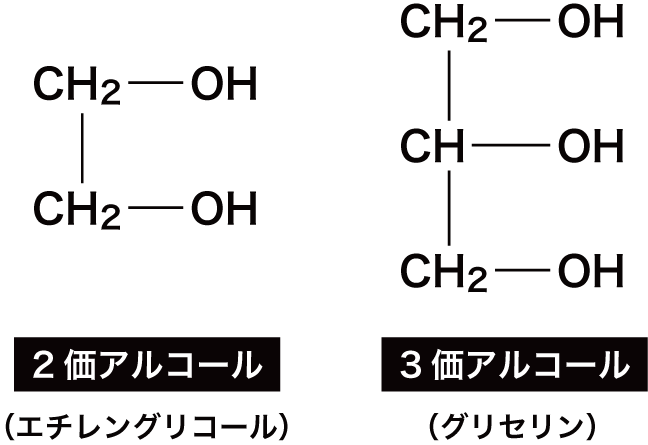
アルコールの価数
- 分子内に存在するヒドロキシ基(-OH)の数をアルコールの価数という。
- 分子内に存在するヒドロキシ基が1個の場合は1価アルコール、2個の場合は2価アルコール、3個の場合は3価アルコールという。

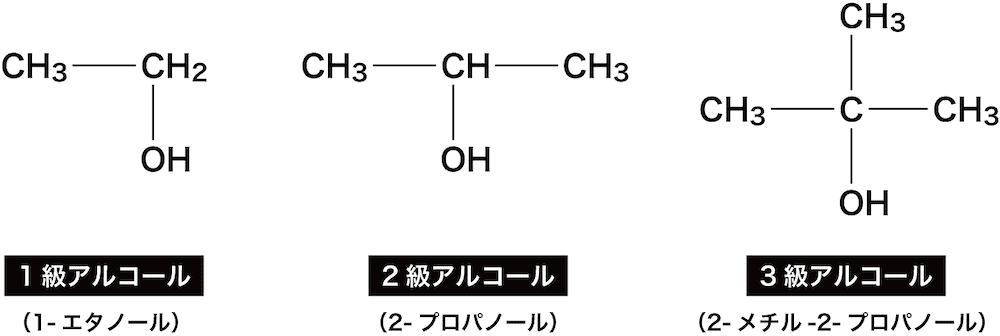
アルコールの級数
- ヒドロキシ基(-OH)が結合した炭素に付いている炭素の数をアルコールの級数という。
- 炭素が1個の場合は第1級アルコール、2個の場合は第2級アルコール、3個の場合は第3級アルコールという。

アルコールの製法
- アルコールの製法として知っておくべきは次の3つである。
●アルコールの製法
- アルケンの水H2O付加
- メタノールの工業的製法
- エタノールの工業的製法
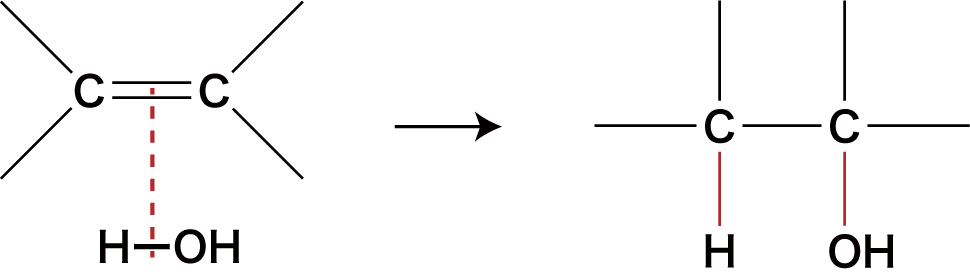
❶ アルケンの水H2O付加
- アルケンに水H2Oを付加させることでアルコールが生成する。

参考:アルケン(一般式の作り方・一覧・命名法・製法・付加反応など)
❷ メタノールの工業的製法
- 一酸化炭素COと水素H2を反応させることでメタノールCH3OHが発生する。
\[ \mathrm{CO + 2H_{2} → CH_{3}OH} \]
❸ エタノールの工業的製法
- エタノールはグルコースC6H12O6を発酵させることで発生する。
\[ \mathrm{C_{6}H_{12}O_{6} → 2C_{2}H_{5}OH + 2CO_{2}} \]
アルコールの反応①(ナトリウムNaとの反応)
- アルコール(のヒドロキシ基)はアルカリ金属であるナトリウムNaと反応しナトリウムアルコキシドとなる。
\[ \mathrm{R-OH + Na → R-ONa + \frac{1}{2}H_{2}} \]
- このとき水素が発生するため、この反応はヒドロキシ基(-OH)の検出反応として用いられる(異性体であるエーテルとの区別)。
- 具体的な反応例としてエタノールC2H5OHとナトリウムNaの反応を確認しておこう。
\[ \mathrm{2C_{2}H_{5}OH + 2Na → 2C_{2}H_{5}ONa + H_{2}} \]
- この反応ではナトリウムアルコキシドの一種であるナトリウムエトキシドが生成している。
アルコールの反応②(脱水反応)
- 脱水作用をもつ濃硫酸H2SO4を触媒としてアルコールを加熱脱水すると、アルケンが生成する。
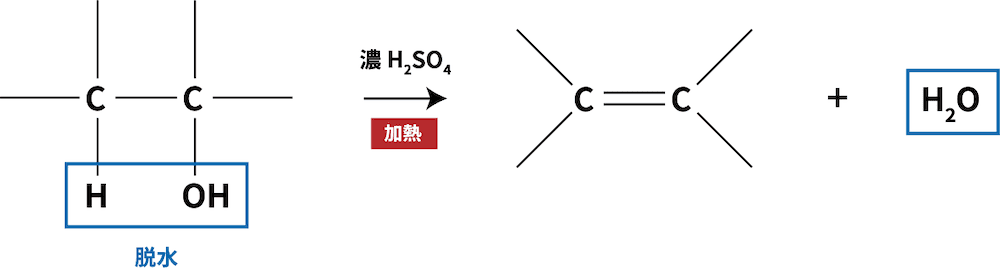

ex)エタノールの脱水によるエチレンの生成反応
- アルコールであるエタノールC2H5OHを脱水すると、エチレンC2H4が生じる。
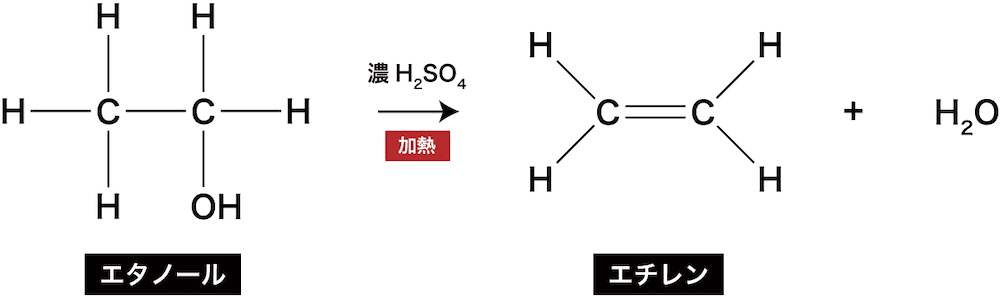

- アルコールの脱水反応はアルケンの製法として有名である。
参考:アルケン(一般式の作り方・一覧・命名法・製法・付加反応など)
ザイツェフ則
- アルコールの脱水反応を考える際は、ザイツェフ則というルールを考慮する必要がある。
●ザイツェフ則
H原子は結合しているHが少ないCから脱離する。
- この法則について、2-ブタノールの脱水を例に解説する。
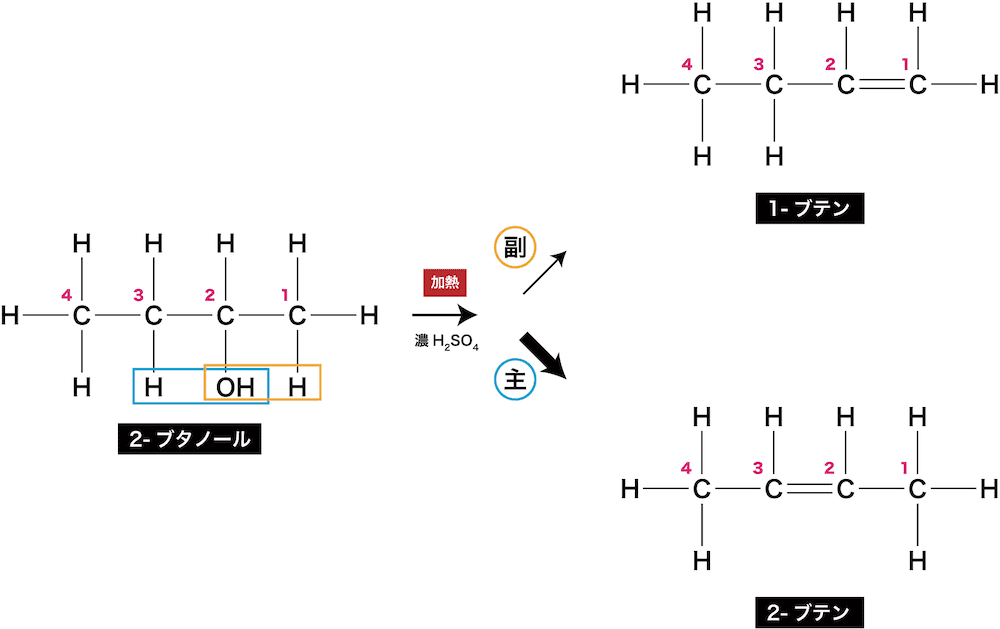

- 2-ブタノール中のヒドロキシ基が付いている炭素(C2)の右の炭素にはHが3つ、左の炭素にはHが2つ付いている。
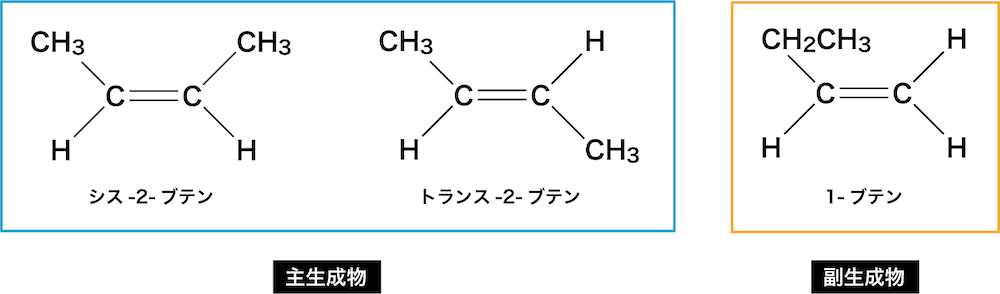
- このような場合、濃H2SO4で脱水しようとすると、ザイツェフ則に基づき、ヒドロキシ基と共に、より付いているHが少ない左側のCからHが引き抜かれる。結果、主生成物は2-ブテン(C-C=C-C)となる。
- また、2-ブテンにはシストランス異性体が存在するため、生成物は全部で3種類になるということも把握しておこう。

脱水時温度による生成物の違い
- 温度の違いにより、脱水した際の主生成物が異なる場合がある。
ex)エタノールC2H5OHの脱水
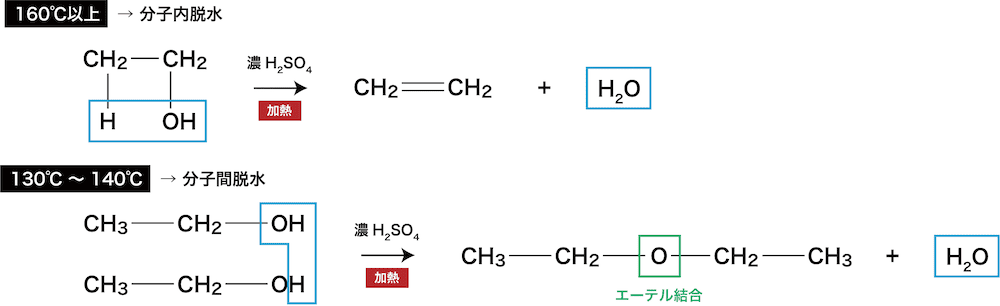

- 低温だと今までやってきたような”分子内”脱水は起こらず、”分子間”での脱水が起こり、2つのアルコールが繫がって「エーテル」が生じる。(エーテルに関しては後述)
アルコールの反応③(酸化反応)
- アルコールの酸化反応は硫酸酸性過マンガン酸カリウムKMnO4水溶液か硫酸酸性二クロム酸カリウムK2Cr2O7水溶液を試薬として用いて行われる。
第1級アルコールの酸化
- 第1級アルコールを酸化すると、一段階目でアルデヒドが、二段階目でカルボン酸が生成する。
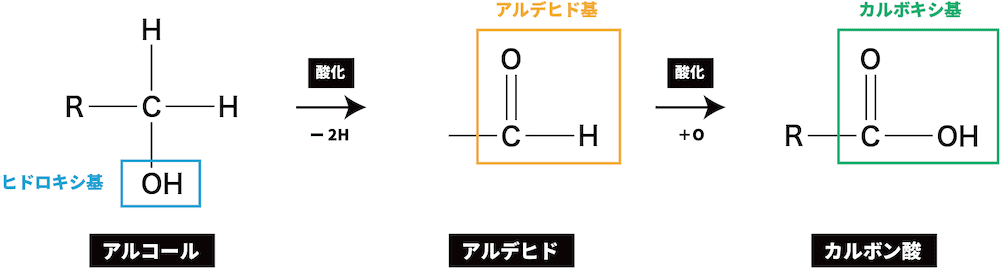

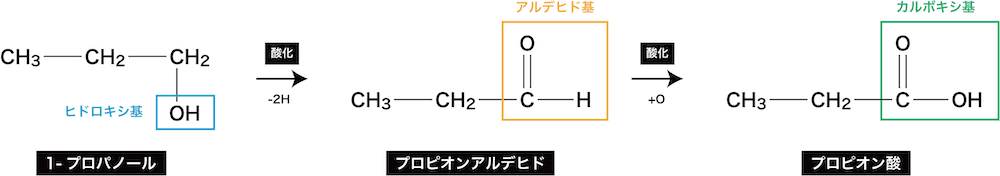
ex1)1-プロパノールの酸化

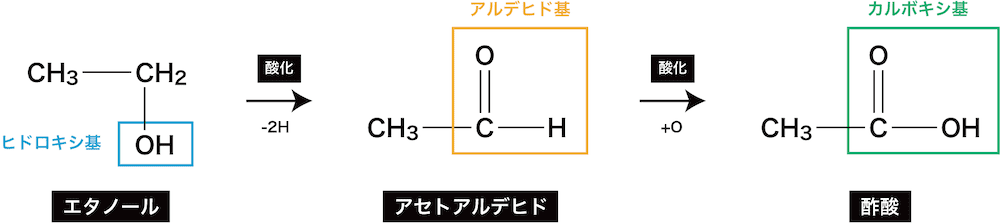
ex2)エタノールの酸化

第2級アルコールの酸化
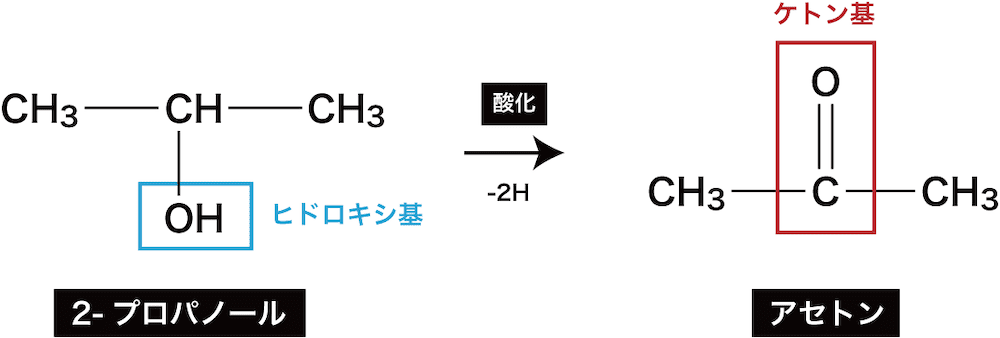
- 第2級アルコールを酸化すると、ケトンが生成する。
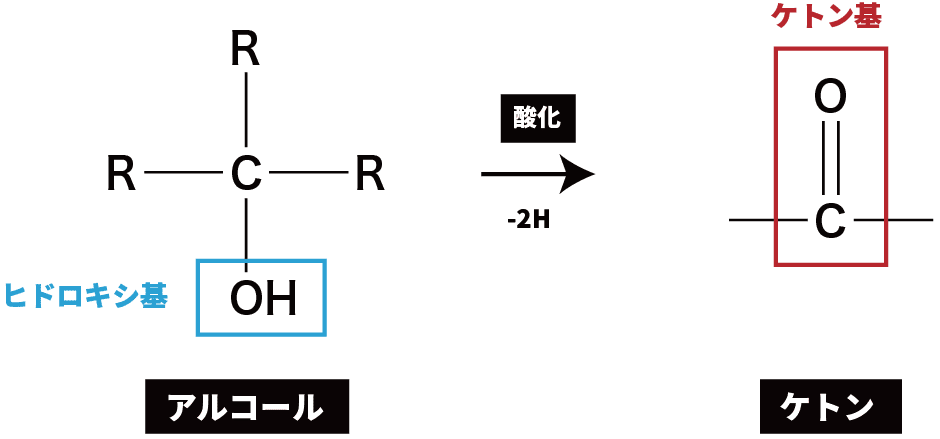

ex)2-プロパノールの酸化

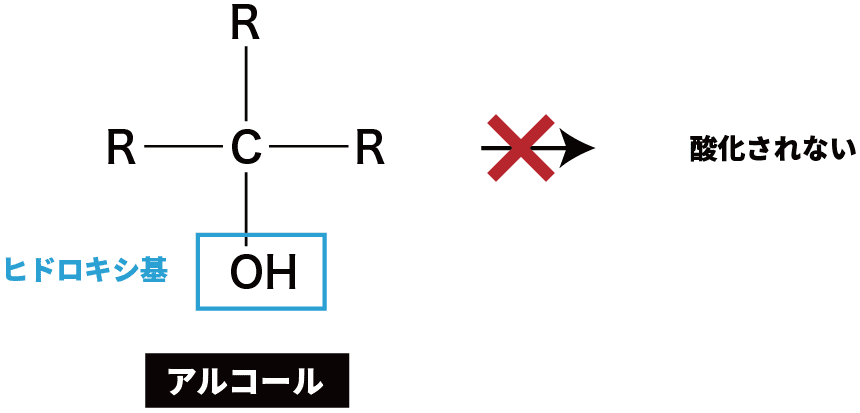
第3級アルコールの酸化
- 第3級アルコールは、Hをもたないため酸化されづらい。

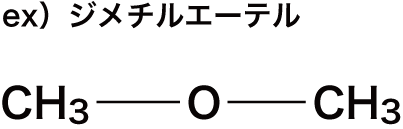
エーテルとは
- エーテル結合(R-O-R‘)をもつ化合物をエーテルという。

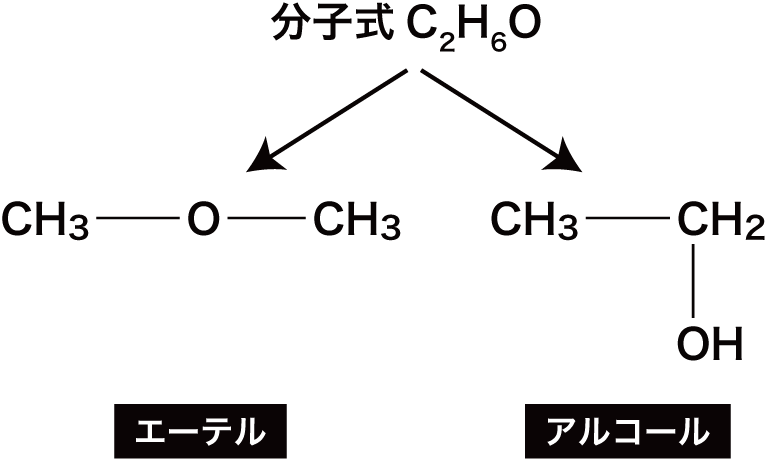
- エーテルは、アルコールと「原子の種類とその数」が一緒であるためアルコールの異性体である。

エーテルの命名法
- エーテルの命名は次の手順で行う。
●STEP1
エーテル結合の両サイドの炭化水素基を確認する。
●STEP2
アルファベットの若い順に官能基名をつける。また、2つの官能基名が同じ場合は官能基名の前に「ジ」をつける。
- ここでは次のエーテルを例に命名の手順を確認する。
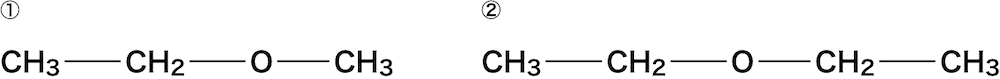
まずは、エーテル結合の両サイドの炭化水素基を確認する。
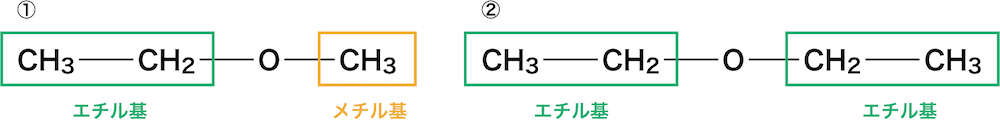

①は左側の官能基がエチル基、右側がメチル基、②は両側ともエチル基である。
次に、アルファベットの若い順に官能基名をつける。また、2つの官能基名が同じ場合は官能基名の前に「ジ」をつける。
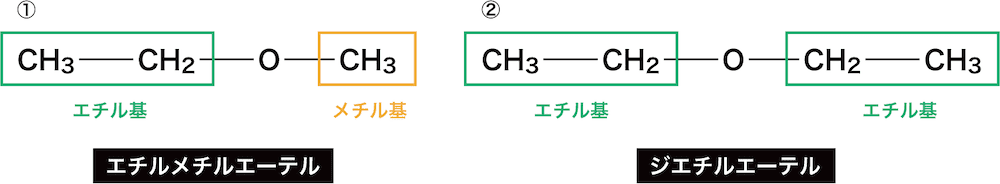

①は”エーテル”の前に2つの官能基をアルファベット順につけて「エチルメチルエーテル」、②はエチル基が2つなのでジエチルエーテルとなる。
エーテルの反応
- エーテルは(異性体であるアルコールと比べて)反応性が極めて低い。
- したがって、アルコールの反応として扱った脱水反応や酸化反応がほとんど起こらない。











