MENU
沈殿生成反応の仕組みと沈殿生成反応式の作り方
目次
はじめに
【プロ講師解説】このページでは『沈殿生成反応の仕組みと沈殿生成反応式の作り方』について解説しています。
イオン結晶が水に溶けやすい理由
- 沈殿生成反応の仕組みを勉強するにあたって、まずは「普通のイオン結晶が水に溶けやすい理由」について確認する。
イオン結晶=陽イオン+陰イオン
- イオン結晶は陽イオンと陰イオンがくっつくことによって形成されている。
- したがって、イオン結晶の極性(電荷の偏り)は非常に大きくなっている。
イオン結晶=極性(大)
- 極性が同じくらいのものを混ぜると溶けやすいというのが溶解反応の原則である。
参考:極性溶媒と無極性溶媒
- 水は有名な極性溶媒であり、同じく極性が高いイオン結晶を混ぜると非常に良く溶ける。
水=極性(大)
イオン結晶=極性(大)
→ 似たもの同士はよく溶ける
- しかし、場合によってこの原則に当てはまらない、つまり、「イオン結晶であるにも関わらず極性溶媒である水に溶けにくいもの」が存在する。
- この”溶けにくい理由”に関しては結晶によって様々なので、高校化学を学んでいる段階では溶けにくい(=沈殿をつくりやすい)ものを”覚える”という方針で勉強していこう。
沈殿生成反応が起こる仕組み
- イオン結晶MXを溶かした水溶液とイオン結晶NYを溶かした水溶液を混ぜる。
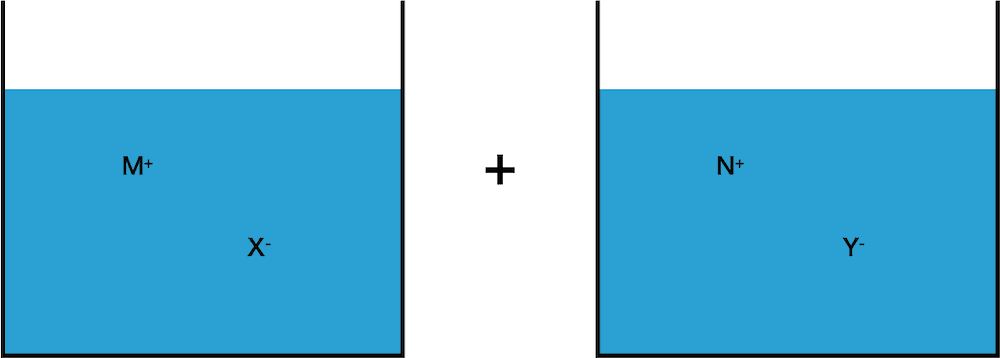

- もし新たに生成するイオン結晶MYが水に溶けにくいイオン結晶ならば、次図のようにMYが沈殿として析出するはずである。
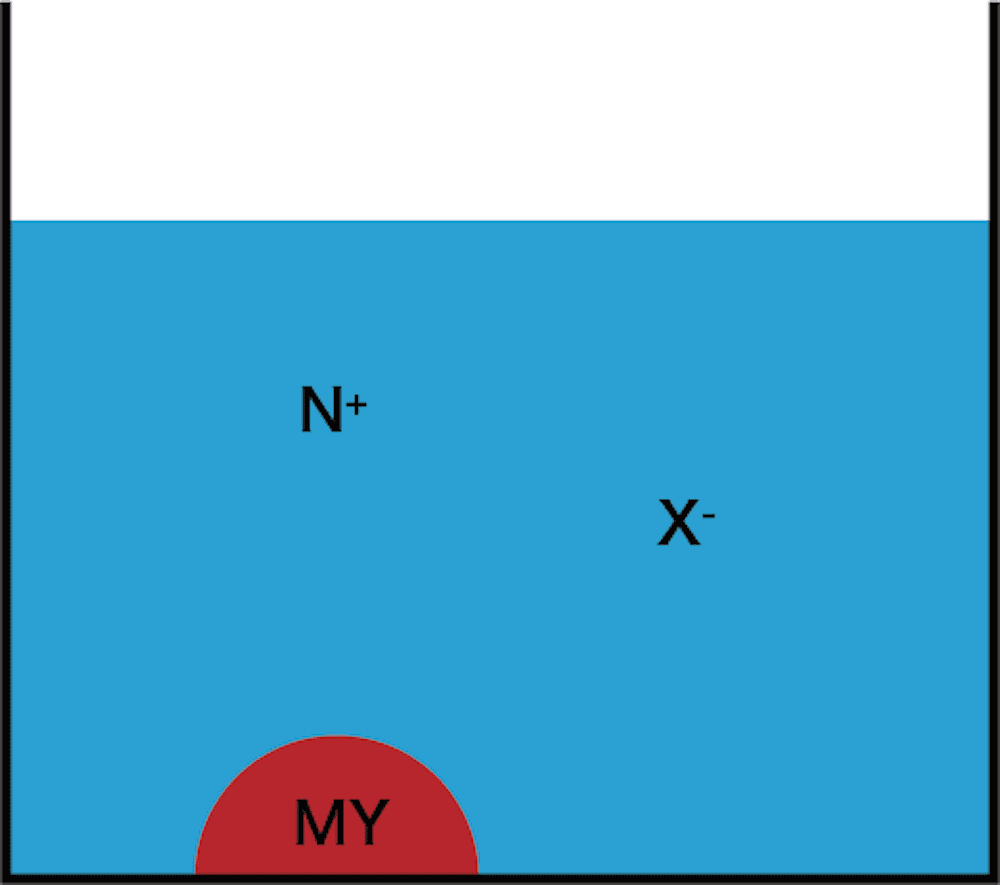

\[ \mathrm{MX(aq)+NY(aq)→MY↓+NX(aq)} \]
- (繰り返すが)このように水に溶けにくい、溶解度の小さいイオン結晶がつくられたときに沈殿が生成する。
沈殿生成反応式の作り方
- 沈殿生成反応の反応式は次の手順で作成する。
●STEP1
2つの化合物をバラバラにし、陽イオンと陰イオンに分ける
●STEP2
STEP1でバラバラにした陽イオンと陰イオンのペアを換えて組み合わせる
●STEP3
STEP2でつくった新たな化合物(イオン結晶)を生成物として反応式を作成する
- 今回は、水酸化バリウムBa(OH)2水溶液と硫酸カリウムK2SO4水溶液を混合したときの沈殿生成反応を例に解説する。
STEP
2つの化合物をバラバラにし、陽イオンと陰イオンに分ける
まず、与えられた2つの化合物(今回はBa(OH)2とK2SO4)をバラバラにし、陽イオンと陰イオンに分ける。
\[ \begin{align}&\mathrm{Ba(OH)_{2} → Ba^{2+} + 2OH^{-}}\\
&\mathrm{K_{2}SO_{4} → 2K^{+} + SO_{4}^{2-}} \end{align}\]
STEP
STEP1でバラバラにした陽イオンと陰イオンのペアを換えて組み合わせる
次に、STEP1でバラバラにした陽イオンと陰イオンのペアを換えて組み合わせる。
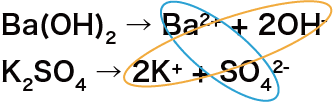
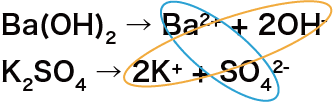
今回は、硫酸バリウムBaSO4と水酸化カリウムKOHが得られる。
STEP
STEP2でつくった新たな化合物(イオン結晶)を生成物として反応式を作成する
最後に、STEP2でつくった新たな化合物(今回はBaSO4とKOH)を生成物として沈殿生成の反応式を完成させる。
\[ \mathrm{Ba(OH)_{2} + K_{2}SO_{4} → BaSO_{4} + 2KOH} \]











