MENU
陽イオンの定性分析〜原理・目的・反応式まとめ〜
はじめに
【プロ講師解説】このページでは『陽イオンの定性分析〜原理・目的・反応式まとめ〜』について解説しています。
陽イオンの定性分析とは
- 複数の陽イオンが含まれる水溶液に対して様々な操作を行うことで沈殿生成反応や炎色反応を引き起こし、その水溶液に含まれる陽イオンを特定する分析法を陽イオンの定性分析という。
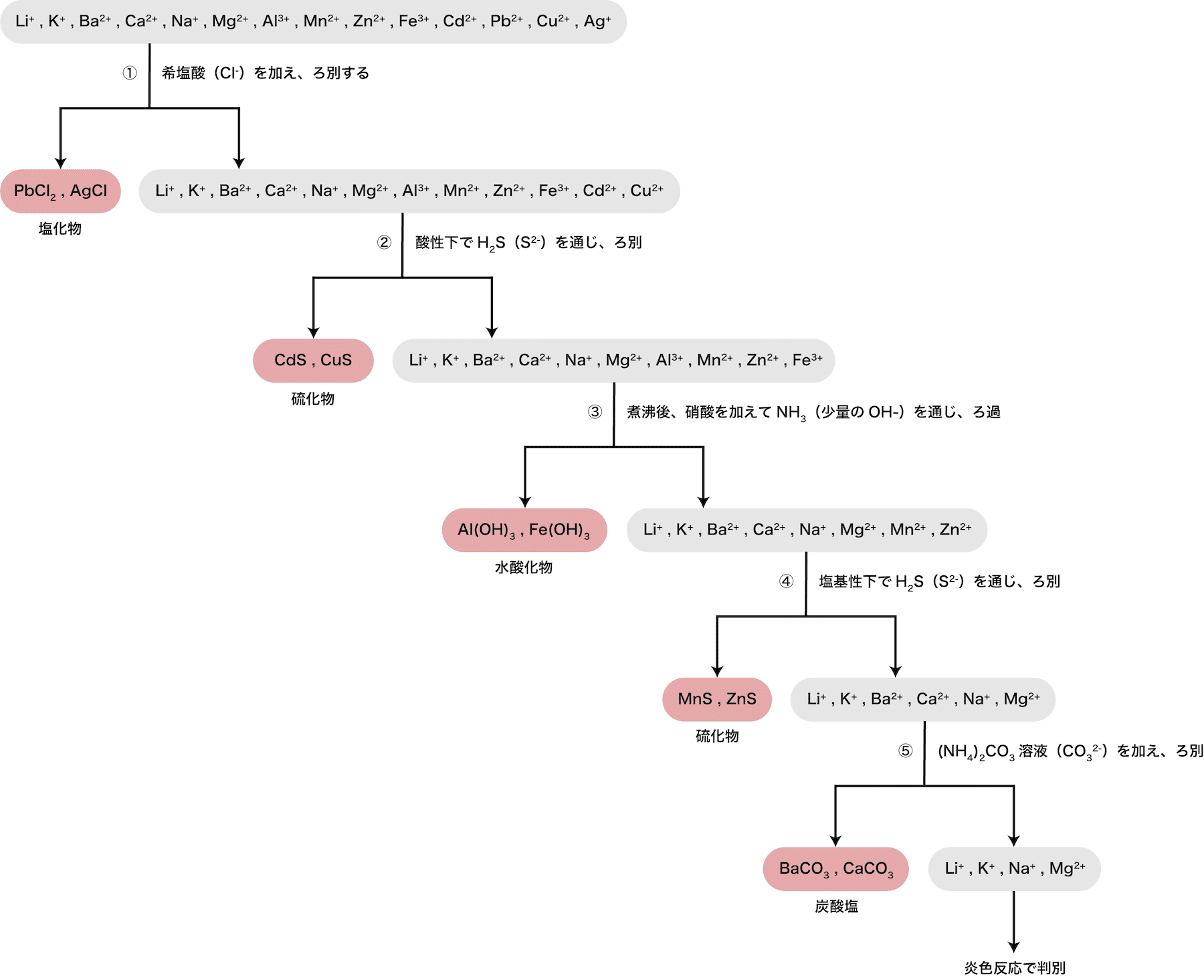


- 上の図のように、①から⑤(+炎色陽イオンが多く含まれる溶液にHClを加える反応)の操作を順番に行うことで、陽イオンをキレイに分離することができる。
- 沈殿生成反応や炎色反応について詳しくは次のページを参照のこと。
陽イオンの定性分析の一連の流れ
- 先述の通り、陽イオンの定性分析は次の流れで行われる。



- 操作①〜⑤について、順に解説する。
まず、陽イオンが多く含まれる溶液にHClを加える。
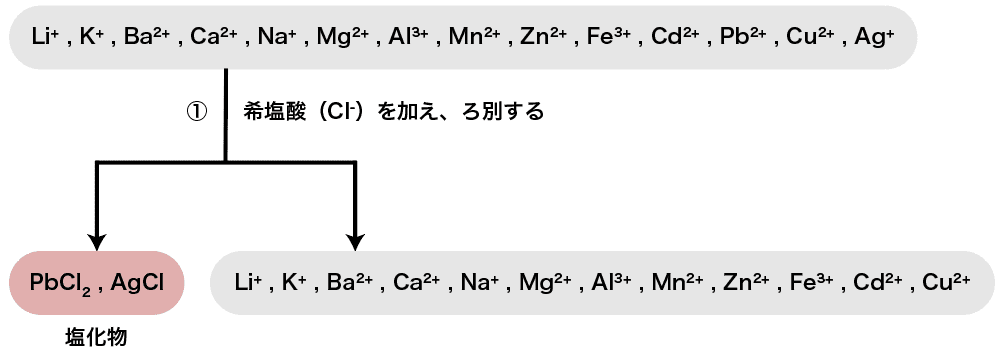

塩化物イオンClーはAg+・Pb2+・Hg22+などと塩化物の沈殿を形成する。
参考:水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム酸・炭酸イオン)
したがって、今回水溶液中に含まれている陽イオンの中ではAg+とPb2+がそれぞれAgCl・PbCl2として沈殿する。
また、沈殿ができた後にろ過操作を行う(=ろ別する)ことで沈殿を取り除く。
次に、酸性下でH2S(S2ー)を通じる。
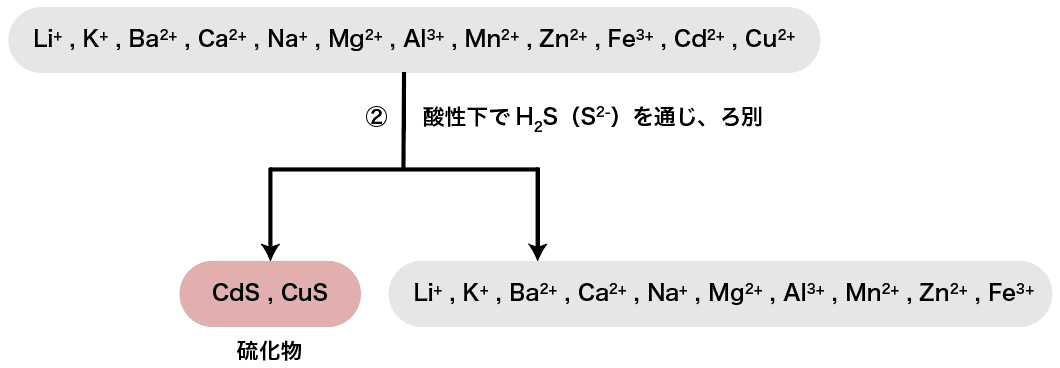

硫化物イオンS2ーは酸性下においてCd2+・Cu2+・Pb2+などと硫化物の沈殿を形成する。
参考:水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム酸・炭酸イオン)
したがって、今回水溶液中に含まれている陽イオンの中ではCd2+・Cu2+がCdS・CuSとして沈殿する。
ちなみに、Pb2+は操作①で既に沈殿として取り除いてしまっているのでここでは沈殿しないこと、この操作は酸性下で行う必要があるが、操作①でHClを加えた結果水溶液は既に酸性になっているため、H2Sを通じるだけでOKということは把握しておこう。
次に、煮沸後硝酸を加え、NH3(少量のOHー)を通じる。
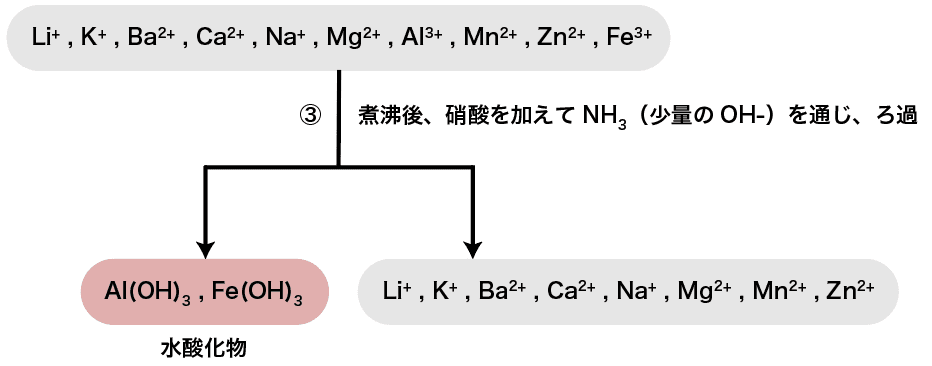

水酸化物イオンOHーはAl3+・Fe3+・Cr3+などと水酸化物の沈殿を形成する。
参考:水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム酸・炭酸イオン)
したがって、今回水溶液中に含まれている陽イオンの中ではAl3+とFe3+がそれぞれAl(OH)3・Fe(OH)3として沈殿する。
この操作では、注目すべき重要なポイントが3つある。順番に確認していこう。
煮沸する理由
煮沸するのはH2Sを追い出すためである。操作2で加えたH2Sを始めに除去しないと、塩基性にした段階でZnS等が沈殿してしまう。(詳しくは操作4へ)
硝酸を加える理由
硝酸を加えるのはH2Sにより還元されたFe2+を酸化して再度Fe3+にするためである。
Fe2+のままだと、OHーを加えたときに(Fe(OH)3ではなく)Fe(OH)2が生じてしまう。
こうなるとFe(OH)2は溶解度が極めて大きいので完全には沈殿せず、鉄イオンを上手く取り出すことができなくなる。
Zn(OH)2が生じない理由
Zn2+はOHーと沈殿Zn(OH)2を形成しやすい。
しかし、アンモニアを加えることで、錯イオン[Zn(NH3)4]2+を作って沈殿が溶解する。
その結果、この段階では沈殿として出てくることはない。
次に、塩基性下でH2S(S2ー)を通じる。
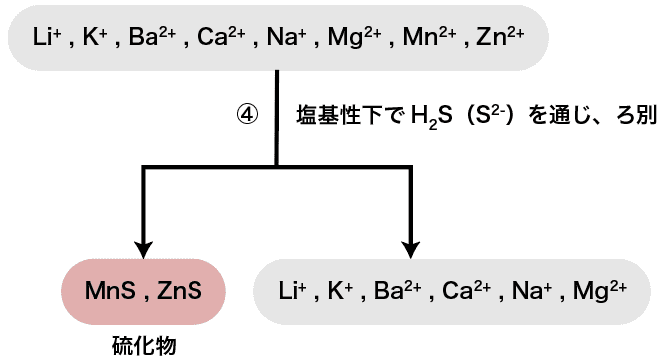

塩基性下において硫化物イオンS2ーはZn2+・Co2+・Ni2+・Mn2+などと硫化物の沈殿を形成する。
参考:水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム酸・炭酸イオン)
したがって、今回水溶液中に含まれている陽イオンの中ではMn2+・Zn2+がMnS・ZnSとして沈殿する。
次に、(NH4)2CO3溶液(CO32ー)を加える。
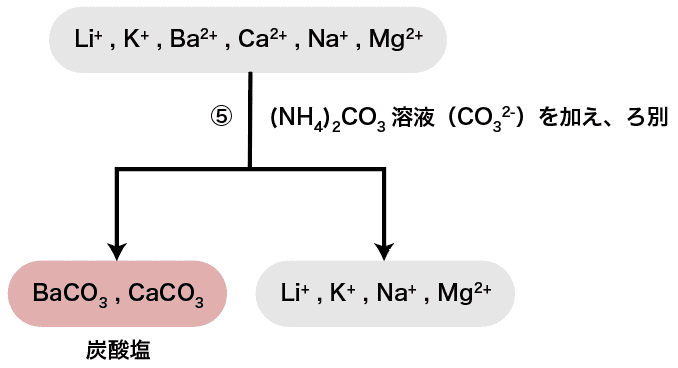

炭酸イオンCO32ーはCa2+・Ba2+などと炭酸塩の沈殿を形成する。
参考:水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム酸・炭酸イオン)
したがって、今回水溶液中に含まれている陽イオンの中ではCa2+とBa2+がそれぞれCaCO3・BaCO3として沈殿する。また、(NH4)2CO3溶液を加える代わりにCO2を吹き込んでも同じ反応が起こる。