MENU
銅の単体・酸化物・銅原子を含む塩の性質や製法など
目次
はじめに
【プロ講師解説】このページでは『銅の単体・酸化物・銅原子を含む塩の性質や製法など』について解説しています。
銅の特徴
- 銅の特徴は次の通りである。
●銅Cuの単体の特徴
- 赤みを帯びた金属光沢をもつ
- 展性・延性に富む
- 熱・電気伝導性が大きい
- 合金として用いられる
- 湿った空気中に放置すると緑青を生じる
- 工業的製法:電解精錬
❶ 赤みを帯びた金属光沢をもつ
- 銅の単体は赤みを帯びた金属光沢をもつ。
- 他の多くの金属は銀に近い色をしているため、これは銅の特徴的な性質である。
参考:無機化学の色まとめ(イオン/化合物(沈殿)/ハロゲンなど)
❷ 展性・延性に富む
- 展性・延性の定義は次の通りである。
| 展性 | 薄く広げることができる性質(例:金箔) |
| 延性 | 長く延ばすことができる性質(例:銅線) |
- 銅は展性・延性に富み、加工がしやすい。したがって、硬貨や調理器具などに用いられる。
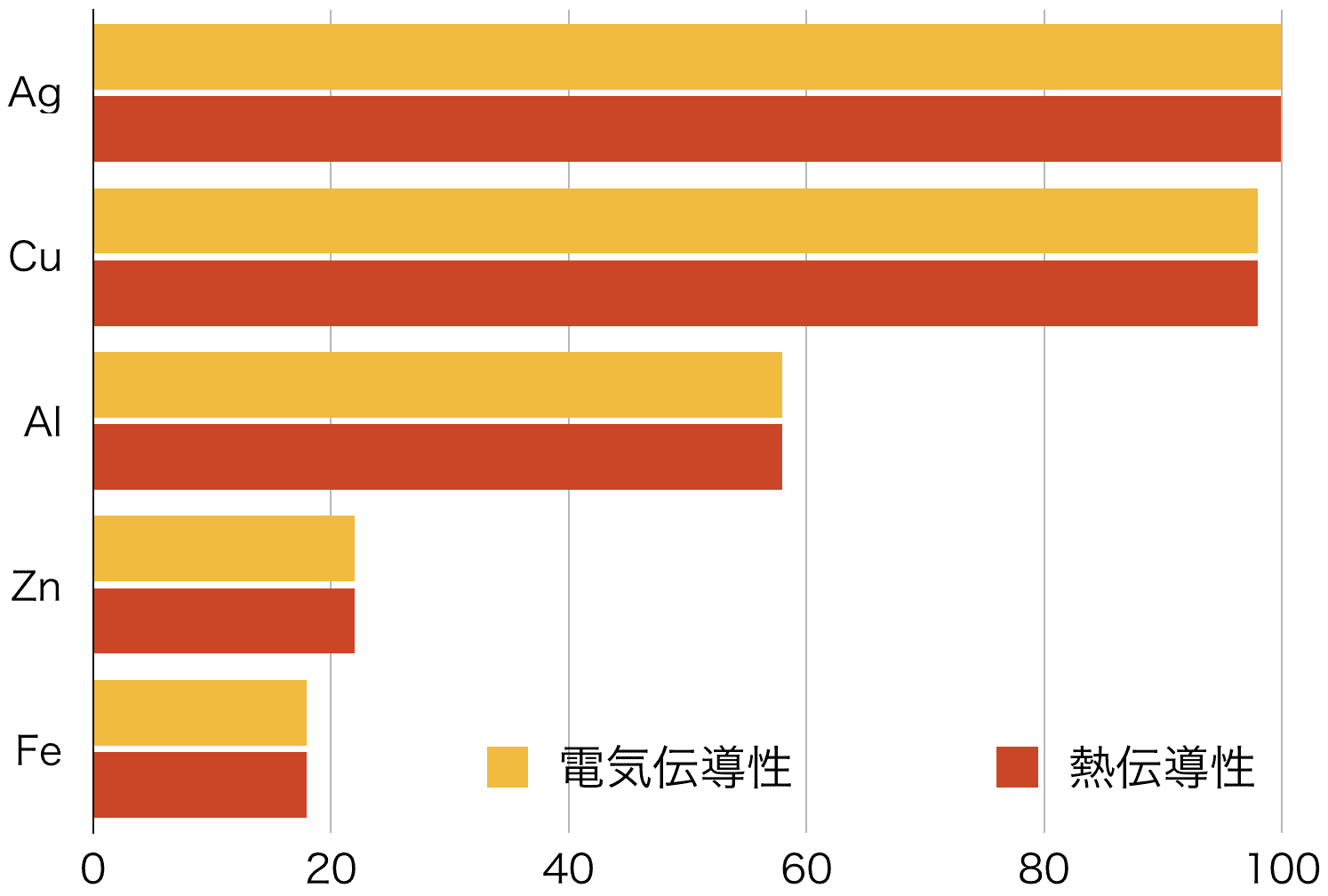
❸ 熱・電気伝導性が大きい
- 金属単体の中で最も電気伝導性が大きいのは銀である。
- 銅は、銀に次いで電気伝導性が大きい。この性質を利用して、熱交換器や電気材料として用いられる。

参考:金属結合(例・強さ・自由電子の役割など)
参考:遷移元素「銀・金・白金・クロム・マンガン・コバルト・チタン」の単体・化合物の性質や製法など
❹ 合金として用いられる
- 複数の金属を混ぜてつくられる金属を合金という。
- 銅は柔らかい金属のため、強度を増すために他の金属と混ぜ、合金として用いられる場合がある。
黄銅(銅+亜鉛)
- 銅に亜鉛Znを混ぜ合わせてつくられる合金を黄銅(おうどう)という。
- 黄銅はほどよい硬さで加工性が高く、楽器や機械部品などに用いられる。
青銅(銅+スズ)
- 銅にスズSnを混ぜ合わせてつくられる合金を青銅(せいどう)という。
- 青銅は黄銅以上の硬度や耐食性をもち、銅像や水道器具などに用いられる。
白銅(銅+ニッケル)
- 銅にニッケルNiを混ぜ合わせてつくられる合金を白銅(はくどう)という。
- 白銅は銀白色で硬く、耐食性をもつ。硬貨や熱交換器、食器などに用いられる。
参考:めっき・合金一覧
❺ 湿った空気中に放置すると緑青を生じる
- 銅を湿った空気中に放置すると、空気中の水分と二酸化炭素の作用で、表面に青緑色のさびを生じる。このさびを緑青(ろくしょう)という。
\[ \mathrm{2Cu+O_{2}+CO_{2}+H_{2}O}→ \underbrace{ \mathrm{CuCO_{3}・ Cu(OH)_{2}} }
_{ \text{ 緑青 }} \]
- 神社の屋根や銅像などが緑色になっているのはこの緑青が原因である。
❻ 工業的製法:電解精錬
- 銅は粗銅の精製と電解精錬を行うことによってつくられる。
- 銅の製法について詳しくは次のページを参照のこと。
銅の酸化物
- 銅の酸化物は酸化銅(Ⅱ)CuOと酸化銅(Ⅰ)Cu2Oの2種類存在する。
酸化銅(Ⅱ)CuO
- 銅の単体を1000℃以下で加熱すると、黒色の酸化銅(Ⅱ)CuOが生じる。
\[ \mathrm{Cu → CuO}(黒色) \]
酸化銅(Ⅰ)Cu2O
- 銅の単体を1000℃以上で加熱すると、赤色の酸化銅(Ⅰ)Cu2Oが生じる。
\[ \mathrm{CuO → Cu_{2}O}(赤色) \]
- Cu2Oはフェーリング反応によって生じる物質であり、アルデヒド基(ーCHO)の検出に用いられる。
銅を含む塩
- 銅を含む塩として入試等で頻出なのは硫酸銅(Ⅱ)CuSO4である。
- 酸化物のところで登場した酸化銅(Ⅱ)CuOは塩基性酸化物の一種であり、酸である硫酸H2SO4と次のような反応を起こす。
\[ \mathrm{CuO + H_{2}SO_{4} → CuSO_{4}+H_{2}O} \]
- この反応により生じたCuSO4水溶液から結晶を析出させると、青色の硫酸銅五水和物CuSO4・5H2Oを得ることができる。
- このCuSO4・5H2Oを加熱すると、徐々にH2Oがとれて最終的に無水和物であるCuSO4の白色沈殿となる。
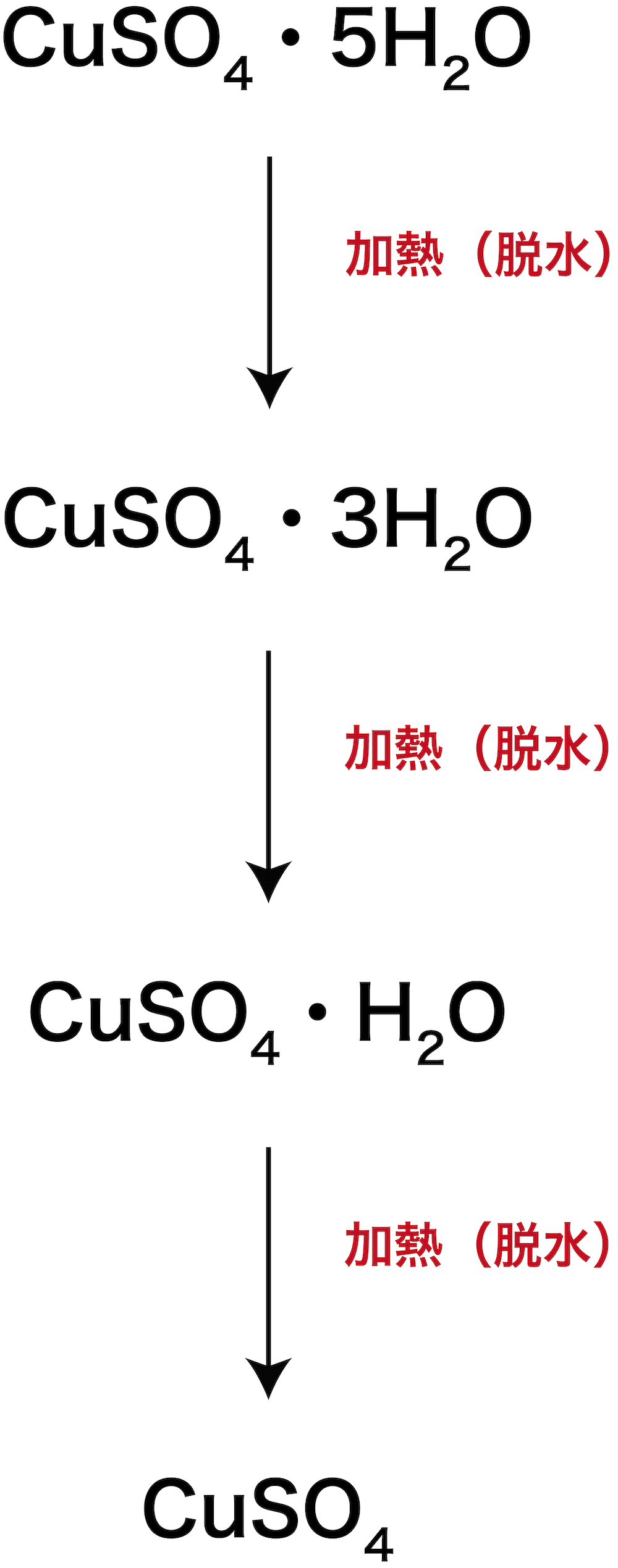

- なお、 硫酸銅五水和物CuSO4・5H2Oについて詳しくは次のページを参照のこと。











