MENU
ハロゲン単体・ハロゲン化水素の性質・製法
はじめに
【プロ講師解説】このページでは『ハロゲン単体・ハロゲン化水素の性質・製法』について解説しています。
ハロゲン単体
- ハロゲン単体(F2・Cl2・Br2・I2)の性質などを一覧表にまとめる。
| 単体 | 融点 | 沸点 | 状態 | 色 | 酸化力 | 水素との反応 | 水との反応 |
|---|---|---|---|---|---|---|---|
| F2 | -220 | -188 | 気体 | 淡黄色 | ++++ | 低温・暗所でも爆発的に反応 | 激しく水と反応し、酸素が発生 |
| Cl2 | -101 | -34 | 気体 | 黄緑色 | +++ | 常温でも光を当てることで爆発的に反応 | 少し水に溶け、一部が水と反応 |
| Br2 | -7 | 59 | 液体 | 赤褐色 | ++ | 高温で触媒を使うと反応 | 塩素より弱く、水と反応 |
| I2 | 114 | 184 | 固体 | 黒紫色 | + | 高温で触媒を使うと一部が反応 | 水に溶けにくく、反応しにくい |
ハロゲン単体の化学式
- ハロゲンの単体は全て二原子分子として存在しており、化学式は次の通りである。
| 名称 | 化学式 |
|---|---|
| フッ素 | F2 |
| 塩素 | Cl2 |
| 臭素 | Br2 |
| ヨウ素 | I2 |
ハロゲン単体の色
- ハロゲン単体(F2・Cl2・Br2・I2)の色は次の通りである。
| ハロゲン単体 | 色 |
|---|---|
| F2 | 淡黄色 |
| Cl2 | 黄緑色 |
| Br2 | 赤褐色 |
| I2 | 黒紫色 |
参考:無機化学の色まとめ(イオン/化合物(沈殿)/ハロゲンなど)
ハロゲン単体の状態
- ハロゲン単体(F2・Cl2・Br2・I2)の常温常圧時の状態は次の通りである。
| ハロゲン単体 | 状態 |
|---|---|
| F2 | 気体 |
| Cl2 | 気体 |
| Br2 | 液体 |
| I2 | 固体 |
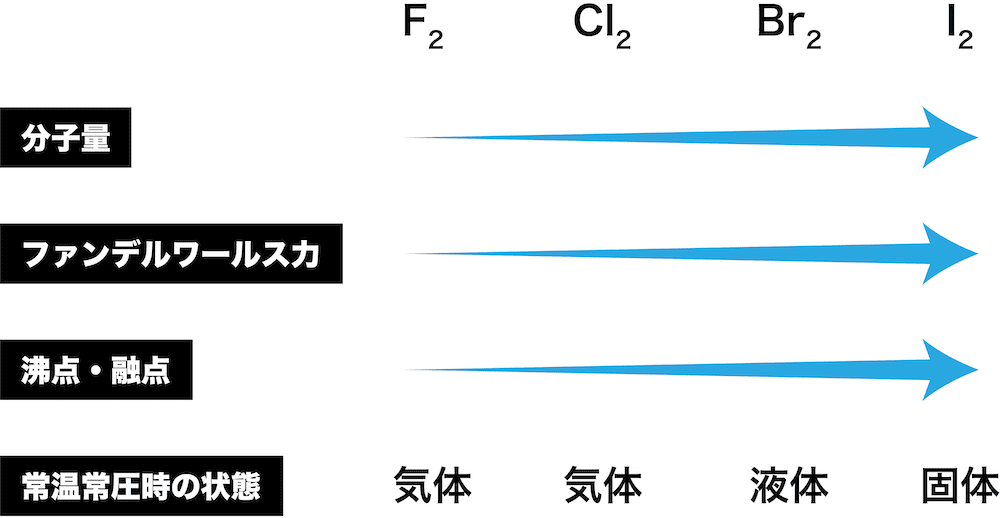
- 常温常圧時の状態が、フッ素F2と塩素Cl2で気体、臭素Br2で液体、ヨウ素I2で固体になる理由について解説する。
- 分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)にあるように、分子量が大きい分子ほど、ファンデルワールス力(分子間力の一種)が大きい。
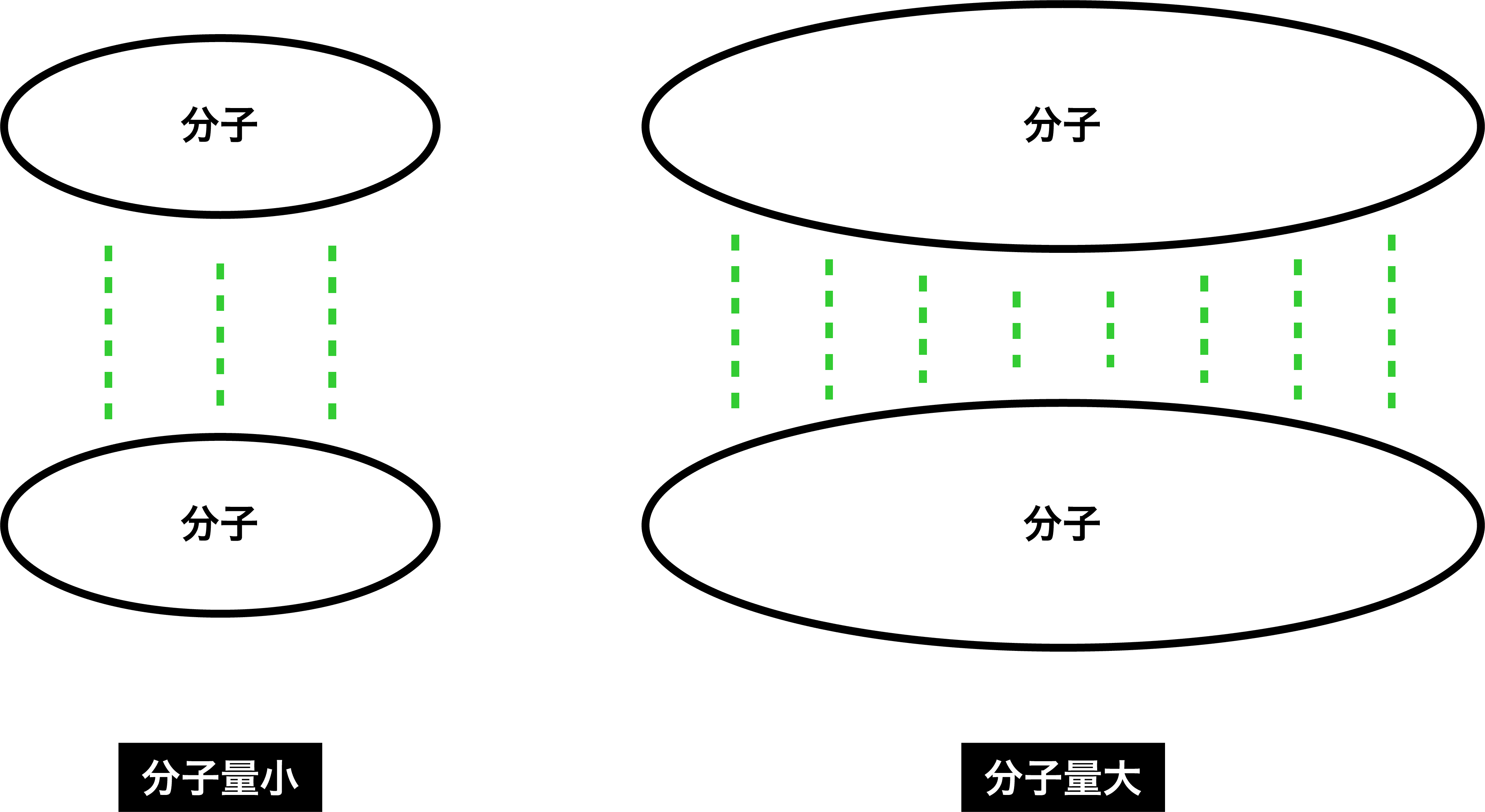

- したがって、ハロゲン単体の分子間力の大きさは次のようになる。
\[
\mathrm{F_{2}<Cl_{2}<Br_{2}<I_{2}}
\]
- また、分子間力が大きい分子ほど、分子間の結合が強い。
- 分子間の結合が強いと、結合が切れることによる「固体→液体→気体」の変化が起こりにくく、沸点や融点が高い。
- 以上を考慮すると、ハロゲン単体の常温常圧時の状態は次のようになる。

参考:【物質の三態】状態変化とは?原理や用語(凝縮・昇華等)を図を使って解説!
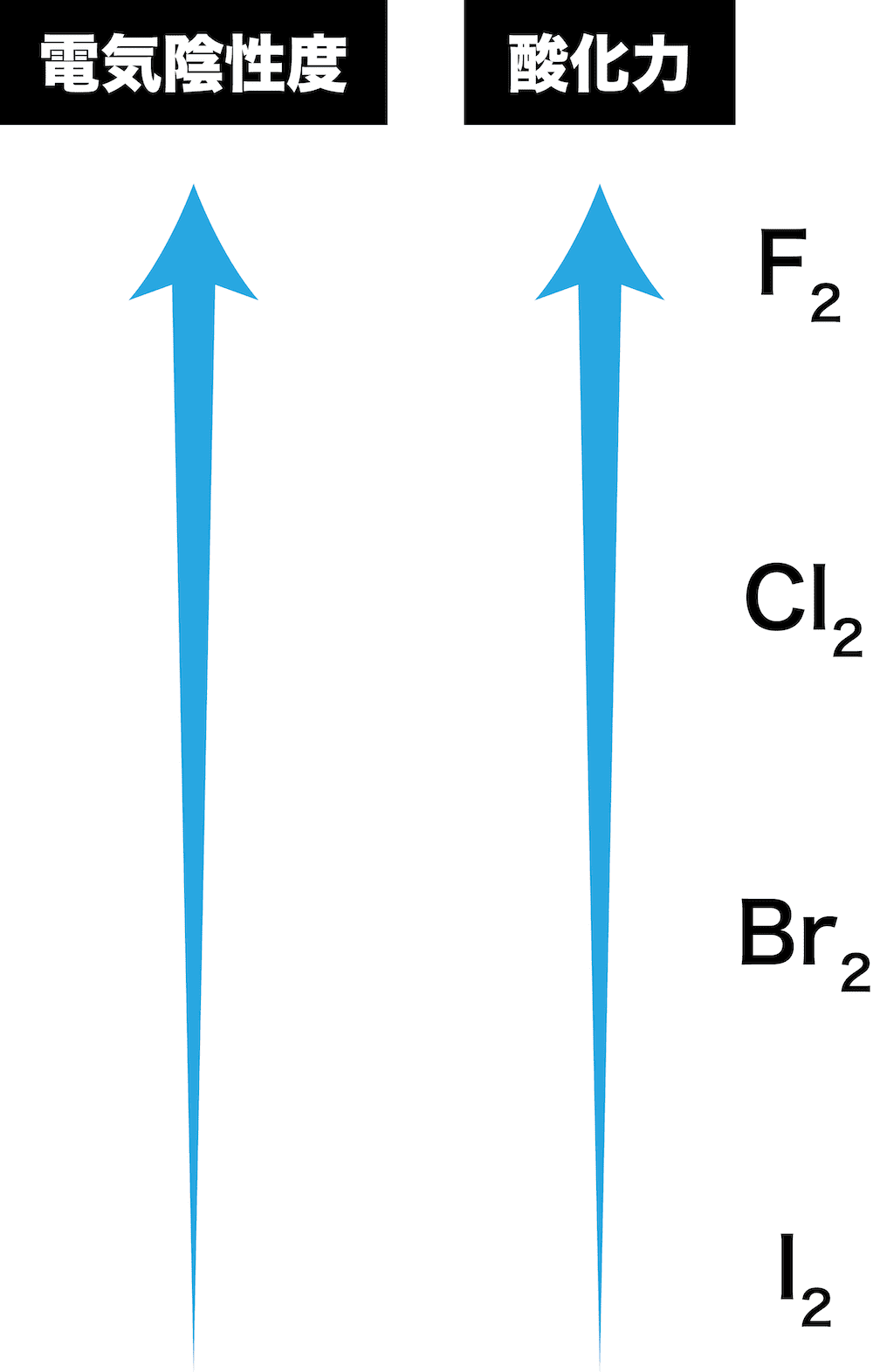
ハロゲン単体の酸化力
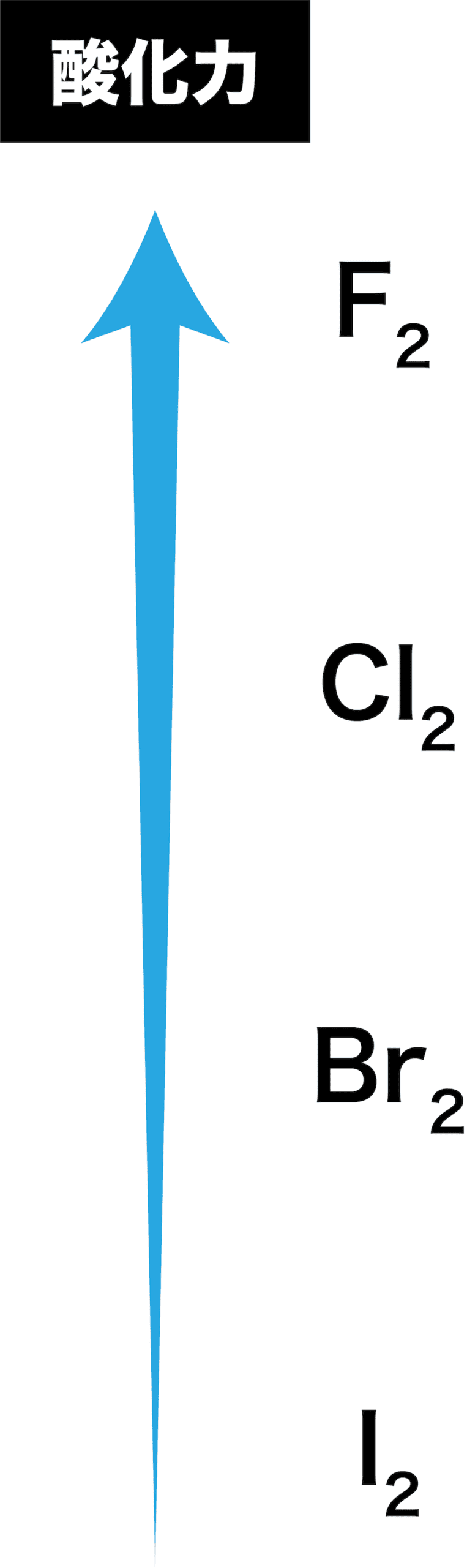
- ハロゲン単体は酸化剤としてはたらく。
- このときの酸化力の強弱は次の順である。

- 酸化剤としての強さは、電気陰性度の大小と深く関係している。
- 電気陰性度(表・覚え方・一覧・電子親和力との関係など)にあるように、電気陰性度とは電子を自分の方に引っ張る強さである。
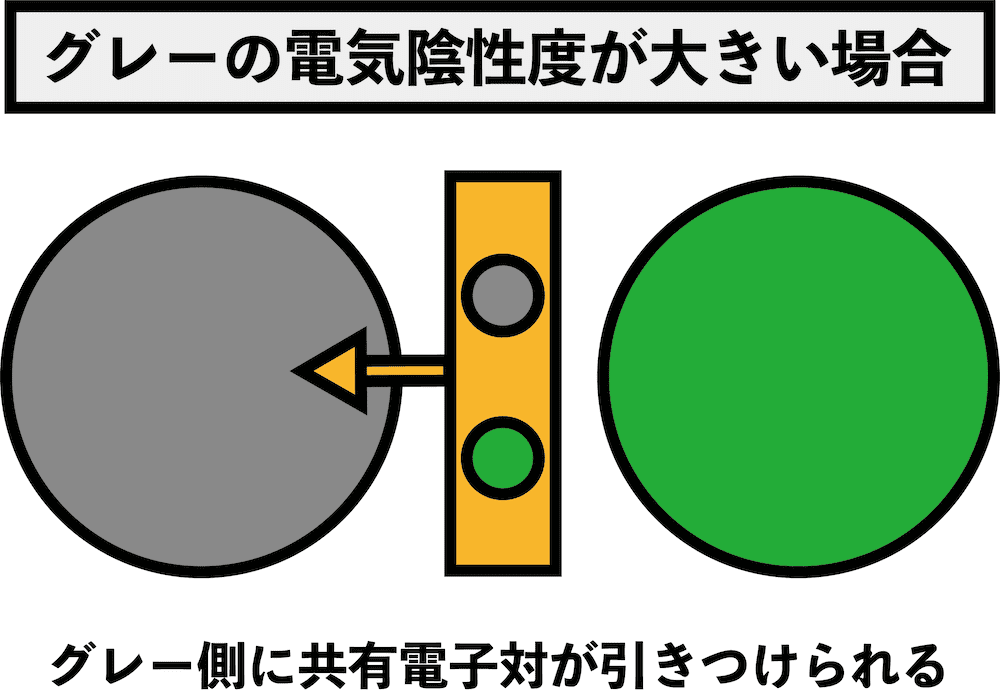

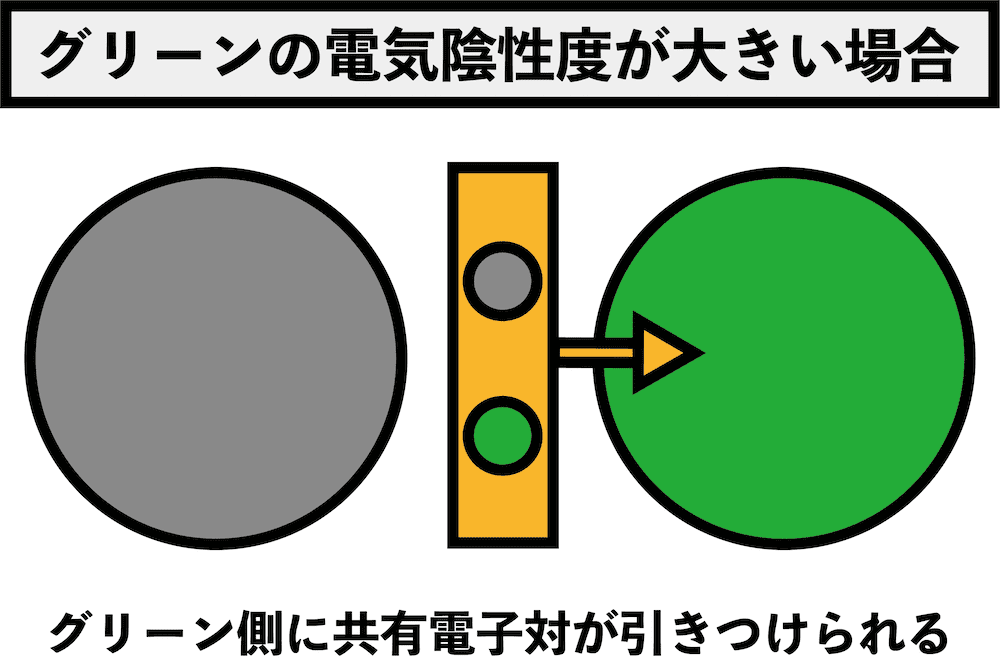

- したがって、電気陰性度が大きい方が相手のもつeーを引っ張る力が強い、つまり、相手のもつeーを奪いやすい。
- 「eーを奪われること」は「酸化されること」を意味するので、「電気陰性度が大きい=相手を酸化しやすい=酸化力が強い」となる。
- 以上を考慮すると、ハロゲンの酸化力は次のような順になる。

参考:電気陰性度(表・覚え方・一覧・電子親和力との関係など)
ハロゲン単体と水素H2の反応
- ハロゲン単体(F2・Cl2・Br2・I2)と水素H2の反応は次の通りである。
| ハロゲン単体 | 色 |
|---|---|
| F2 | 低温・暗所でも爆発的に反応 |
| Cl2 | 常温でも光を当てることで爆発的に反応 |
| Br2 | 高温で触媒を使うと反応 |
| I2 | 高温で触媒を使うと一部が反応 |
- ハロゲンの単体と水素H2との反応でも、ポイントは”酸化力”である。
- F2は酸化力が高いため、低温や暗所であってもH2と爆発的に反応する。
\[
\mathrm{H_{2} + F_{2} → 2HF}
\]
- また、F2の次に酸化力の強いCl2は(低温や暗所では難しいものの)常温で光を当てれば反応する。
\[
\mathrm{H_{2} + Cl_{2} → 2HCl}
\]
- Br2やI2は酸化力が低いため、高温下で触媒を使う必要がある。
\[
\begin{align}&\mathrm{H_{2} + Br_{2} \overset{触媒}{→} 2HBr}\\
&\mathrm{H_{2} + I_{2} \overset{触媒}{→} 2HI}\end{align}
\]
ハロゲン単体と水H2Oの反応
- ハロゲン単体(F2・Cl2・Br2・I2)と水H2Oの反応は次の通りである。
| ハロゲン単体 | 色 |
|---|---|
| F2 | 激しく水と反応し、酸素が発生 |
| Cl2 | 少し水に溶け、一部が水と反応 |
| Br2 | 塩素より弱く、水と反応 |
| I2 | 水に溶けにくく、反応しにくい |
- 先ほどから書いているように、フッ素は酸化力が極めて高いため、水H2Oとも激しく反応する。
\[
\mathrm{2F_{2} + 2H_{2}O → 4HF + O_{2}}
\]
- 塩素は、水に少しだけ溶けて塩素水となる。(塩素の一部はH2Oと次のように反応)
\[
\mathrm{Cl_{2} + H_{2}O → HCl + HClO}
\]
- このとき、HClに含まれるClの酸化数は「ー1」、HClOに含まれるClの酸化数は「+1」になっている。
- つまり、Cl2のうち、片方のClは酸化され、もう片方のClは還元されている。このような反応を自己酸化還元反応という。
- また、このとき発生したHClOは酸化力があり、漂白・殺菌作用をもつということも併せて覚えておくとgood。
- 臭素も塩素同様自己酸化還元反応を起こすが、その反応性は塩素より低い。
\[
\mathrm{Br_{2} + H_{2}O → HBr + HBrO}
\]
- I2は常温常圧で固体であり、分子結晶を形成しているので基本的に水には溶けない。
- ただし、ヨウ化カリウムKI水溶液には溶解し、三ヨウ化物イオンI3ーを生じる。
\[
\mathrm{I^{ー} + I_{2} ⇄ I_{3}^{ー}(褐)}
\]
- このときできる褐色の溶液をヨウ素溶液(ヨウ素液)という。
- ヨウ素液にデンプン水溶液を加えると、青紫色を示す。この反応をヨウ素デンプン反応という。
- ヨウ素デンプン反応は、デンプンの検出などに用いられる。
ハロゲン同士の反応
- ハロゲン同士の反応について、次の問題を用いて解説する。
次のうち、反応が起こるのはどちらか。
① 2KBr + Cl2 →
② 2KCl + Br2 →
① 2KBr + Cl2 →
- BrとClの電気陰性度を比べると、Clの方が大きい。
- 反応前において、電気陰性度の小さいBrが電子の多い陰イオン(Br-)、電気陰性度の大きいClが分子の状態で存在しており、これはおかしい。したがって、次のような反応が起こる。
\[ \mathrm{2KBr+Cl_{2}→2KCl+Br_{2} }\]
- 反応後、電気陰性度の大きいClが電子の多い陰イオン(Cl-)になっているのが確認できる。
② 2KCl+Br2→
- BrとClの電気陰性度を比べると、Clの方が大きい。反応前において、電気陰性度の小さいBrが分子、電気陰性度の大きいClが電子の多い陰イオン(Cl-)の状態で存在している。
- 電子はわざわざ電気陰性度の大きい方から小さい方へ移動しないため、反応は起こらない。
\[ \mathrm{2KCl+Br_{2}→×}\]
塩素のオキソ酸
- オキソ酸とは酸素O原子を含む酸である。
- 塩素のオキソ酸を次に示す。
| 名称 | 次亜塩素酸 | 亜塩素酸 | 塩素酸 | 過塩素酸 |
| 化学式 | HClO | HClO2 | HClO3 | HClO4 |
| Clの酸化数 | +1 | +3 | +5 | +7 |
| 構造式 | 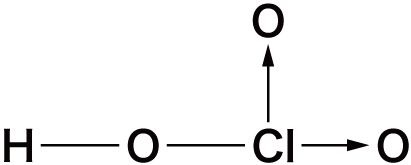  | 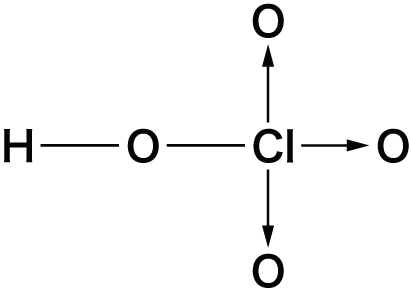  |
オキソ酸の名称は、最も安定しているものを基準とし、中心元素の酸化数が大きいものに「過」、小さいものに「亜」、さらに小さいものに「次亜」をつけます。
塩素のオキソ酸の酸としての強さ
- オキソ酸の酸としての強さは、O原子の数が多いほど強い。
- したがって、塩素のオキソ酸で最も酸として強いのは過塩素酸HClO4、最も弱いのは次亜塩素酸HClOとなる。
\[ \mathrm{HClO < HClO_{2} < HClO_{3} < HClO_{4} }\]
ハロゲン化水素
- ハロゲンと水素から成る化合物をハロゲン化水素という。
- ハロゲン化水素を水に溶解させてできた水溶液をハロゲン化水素酸という。
| 名称 | 化学式 |
|---|---|
| フッ化水素(フッ化水素酸) | HF |
| 塩化水素(塩酸) | HCl |
| 臭化水素(臭化水素酸) | HBr |
| ヨウ化水素(ヨウ化水素酸) | HI |
ハロゲン化水素酸としての名称を()内に示しています。
ハロゲン化水素の酸としての強さ
- ハロゲン化水素のうち、フッ化水素HFのみ弱酸、その他は強酸である。
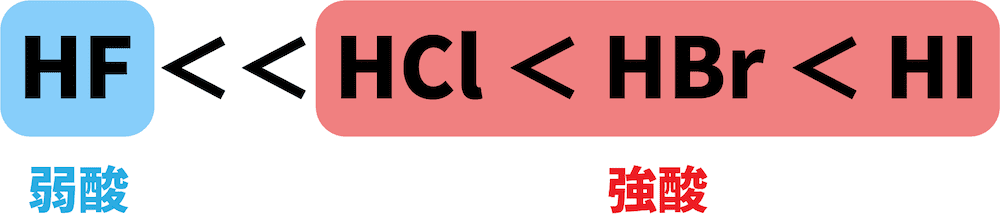
ハロゲン化水素の沸点
- ハロゲン化水素の沸点をグラフにすると、次のようになる。
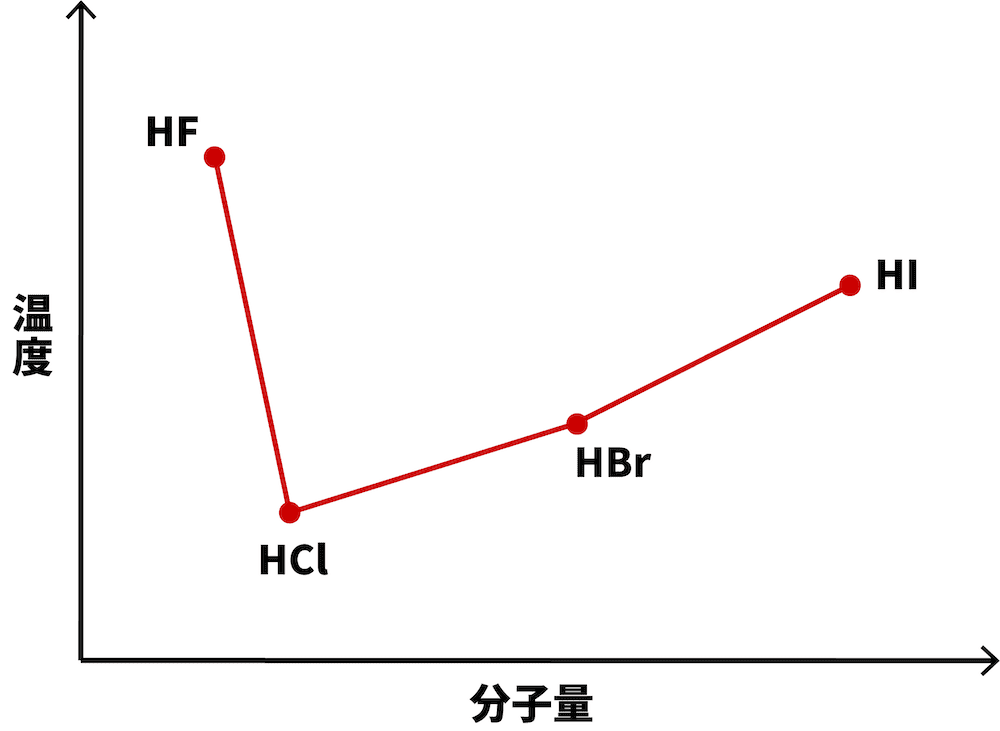

- 基本、ハロゲン化水素の沸点は分子量に比例する。
- これは、分子量の大きい方がファンデルワールス力が大きくなり、分子間の結合が切れにくくなるためである。
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
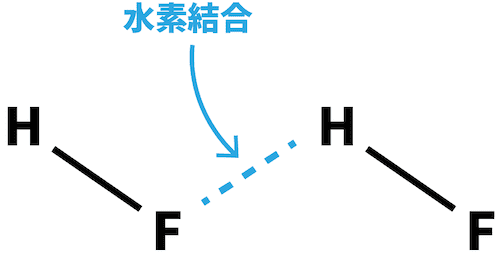
- フッ化水素は水素結合を形成するため、分子量の割に沸点が高い。

銀イオンとハロゲン化物イオン
- 銀イオンAg+とハロゲン化物イオンの反応は、生成物の色が特徴的である。
\[
\begin{align}&\mathrm{Ag^{+}+F^{-}→AgF(溶ける)}\\
&\mathrm{Ag^{+}+Cl^{-}→AgCl(白)}\\
&\mathrm{Ag^{+}+Br^{-}→AgBr(淡黄)}\\
&\mathrm{Ag^{+}+I^{-}→AgI(黄)}\end{align}
\]
※AgFは溶けるため沈殿しない。
参考:無機化学の色まとめ(イオン/化合物(沈殿)/ハロゲンなど)
カルシウムイオンとハロゲン化物イオン
- ハロゲン化物イオンのうち、フッ化物イオンFーのみカルシウムイオンCa2+と反応して、フッ化カルシウムCaF2として沈殿する。
\[
\mathrm{Ca^{2+}+2F^{-}→CaF_{2}}
\]
フッ化水素酸の反応
- フッ化水素HFの水溶液であるフッ化水素酸は、ガラス(主成分:二酸化ケイ素SiO2)を溶解させる。
\[
\mathrm{SiO_{2} + 6HF → H_{2}SiF_{6}(ヘキサフルオロケイ素) + 2H_{2}O}
\]
【塩化水素の工業的製法】水素と塩素を反応させる
- 水素H2と塩素Cl2を反応させると、塩化水素HClが得られる。
\[
\mathrm{H_{2} + Cl_{2} → 2HCl}
\]
【塩化水素の実験室的製法】塩化ナトリウムに濃硫酸を加えて加熱する
- 塩化ナトリウムNaClに濃硫酸H2SO4を加えて加熱すると、塩化水素HClが得られる。
\[
\mathrm{NaCl + H_{2}SO_{4} → NaHSO_{4} + HCl}
\]
- この反応は揮発性酸遊離反応の一種である。
2NaCl + H2SO4 → Na2SO4 + 2HClにならない理由
- 塩化水素の実験室的製法(塩化ナトリウムNaClに濃硫酸H2SO4を加えて加熱する)で、次のような反応式を書く人がいるが、これはNGである。
\[ \mathrm{2NaCl + H_{2}SO_{4} → Na2SO_{4} + 2HCl }\]
- H2SO4の電離は第一電離と第二電離に分けられる。
\[ \begin{align}
&【第一電離】\\
&\mathrm{H_{2}SO_{4} → H^{+}+HSO_{4}^{-}}\\
&【第二電離】\\
&\mathrm{HSO_{4}^{-} → H^{+}+SO_{4}^{2-}}
\end{align}\]
- 第二電離は第一電離と比較して、極めて起こりにくい。したがって、HSO4ー→SO42ーの変化が少ないため、この反応の反応式としては、次のものが正しい。
\[ \mathrm{NaCl + H_{2}SO_{4} → NaHSO_{4} + HCl }\]
ハロゲンまとめ
この『ハロゲン単体・ハロゲン化水素の性質・製法』のページで解説した内容をまとめる。
- 周期表において17族の元素をハロゲンという。
- ハロゲン単体(F2・Cl2・Br2・I2)の性質は次の通りである。
| 単体 | 融点 | 沸点 | 状態 | 色 | 酸化力 | 水素との反応 | 水との反応 |
|---|---|---|---|---|---|---|---|
| F2 | -220 | -188 | 気体 | 淡黄色 | ++++ | 低温・暗所でも爆発的に反応 | 激しく水と反応し、酸素が発生 |
| Cl2 | -101 | -34 | 気体 | 黄緑色 | +++ | 常温でも光を当てることで爆発的に反応 | 少し水に溶け、一部が水と反応 |
| Br2 | -7 | 59 | 液体 | 赤褐色 | ++ | 高温で触媒を使うと反応 | 塩素より弱く、水と反応 |
| I2 | 114 | 184 | 固体 | 黒紫色 | + | 高温で触媒を使うと一部が反応 | 水に溶けにくく、反応しにくい |
- ハロゲンと水素から成る化合物をハロゲン化水素という。
- ハロゲン化水素を水に溶解させてできた水溶液をハロゲン化水素酸という。
| 名称 | 化学式 |
|---|---|
| フッ化水素(フッ化水素酸) | HF |
| 塩化水素(塩酸) | HCl |
| 臭化水素(臭化水素酸) | HBr |
| ヨウ化水素(ヨウ化水素酸) | HI |
- ハロゲン化水素のうち、フッ化水素HFのみ弱酸、その他は強酸である。
- ハロゲン化水素の沸点は分子量に比例する。ただし、フッ化水素は水素結合を形成するため、このルールに従わず、最も沸点が高い。
- 銀イオンAg+とハロゲン化物イオンの反応は、生成物の色が特徴的である。
\[
\begin{align}&\mathrm{Ag^{+}+Cl^{-}→AgCl(白)}\\
&\mathrm{Ag^{+}+Br^{-}→AgBr(淡黄)}\\
&\mathrm{Ag^{+}+I^{-}→AgI(黄)}\end{align}
\] - ハロゲン化物イオンのうち、フッ化物イオンFーのみカルシウムイオンCa2+と反応して、フッ化カルシウムCaF2として沈殿する。
\[
\mathrm{Ca^{2+}+2F^{-}→CaF_{2}}
\] - フッ化水素HFの水溶液であるフッ化水素酸は、ガラス(主成分:二酸化ケイ素SiO2)を溶解させる。
\[
\mathrm{SiO_{2} + 6HF → H_{2}SiF_{6} + 2H_{2}O}
\] - 【塩化水素の工業的製法】水素と塩素を反応させる
\[
\mathrm{H_{2} + Cl_{2} → 2HCl}
\] - 【塩化水素の実験室的製法】塩化ナトリウムに濃硫酸を加えて加熱する
\[
\mathrm{NaCl + H_{2}SO_{4} → NaHSO_{4} + HCl}
\]