MENU
【pH計算】定義から公式、求め方、希釈や混合が絡む問題など
はじめに
【プロ講師解説】このページでは『【pH計算】定義から公式、求め方、希釈や混合が絡む問題など』について解説しています。
pHとは
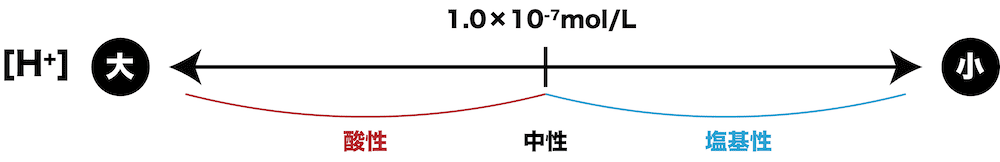
- 水溶液の液性は、水溶液中の水素イオンのモル濃度[H+]で決まる。
- 25℃において、[H+]と液性の関係は次のようになる。
| [H+] | 液性 | |
|---|---|---|
| 純水と同じ | [H+] = 1.0×10ー7(mol/L) | 中性 |
| 純水より大きい | [H+] > 1.0×10ー7(mol/L) | 酸性 |
| 純水より小さい | [H+] < 1.0×10ー7(mol/L) | 塩基性 |

- [H+]は液性を考える上で重要な数値だが、値が小さく扱いづらい。そこで使うのが水素イオン指数(pH)である。
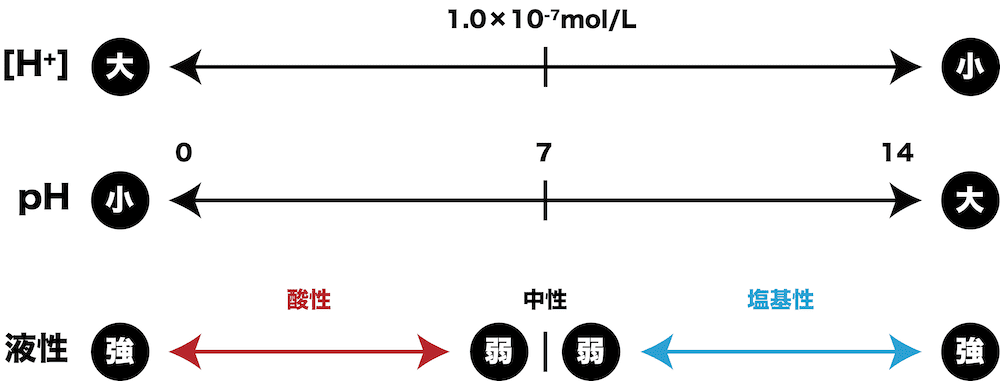
- [H+]とpHには上のような関係がある。
\[ \begin{align}
&\mathrm{[H^{+}]=1.0×10^{-n}mol/L}\\
&\mathrm{→ pH=n}\end{align} \]
- したがって、[H+]・液性・pHの関係をまとめると次のようになる。
| [H+] | 液性 | pH |
|---|---|---|
| [H+] = 1.0×10ー7(mol/L) | 中性 | 7 |
| [H+] > 1.0×10ー7(mol/L) | 酸性 | < 7 |
| [H+] < 1.0×10ー7(mol/L) | 塩基性 | > 7 |

logの使い方
- pH計算をする上で覚えておくべき数学の公式を紹介する。
\[ \begin{align}&\mathrm{①log_{10}A + log_{10}B = log_{10}AB}\\
&\mathrm{②log_{10}A – log_{10}B = log_{10}\frac{ A }{ B }}\\
&\mathrm{③log_{10}10^{A} = A} \end{align}\]
pH計算の公式
- pH計算をする上で覚えておくべき数学の公式を紹介する。
\[ \begin{align}&\mathrm{①pH = -log_{10}[H^{+}]}\\
&\mathrm{②pOH = -log_{10}[OH^{-}]}\\
&\mathrm{③[H^{+}][OH^{-}]=1.0×10^{-14}}\\
&\mathrm{④pH+pOH=14}\\
&\mathrm{⑤[H^{+}]=c×m×α}\\
&\mathrm{⑥[OH^{-}]=c×m×α} \end{align}\]
①pH = ーlog10[H+]
\[ \begin{align}&\mathrm{[H^{+}]=1.0×10^{-n}}\\
&\mathrm{↔ -log_{10}[H^{+}]=-log_{10}10^{-n}(= n)}\\
&\mathrm{↔ pH=-log_{10}[H^{+}]} \end{align}\]
②pOH = ーlog10[OHー]
- pOHは水酸化物イオン指数であり、水溶液中の水酸化物イオンのモル濃度[OHー]との関係は次の通りである(①のOHバージョン!)。
\[ \mathrm{pOH = -log_{10}[OH^{-}]} \]
③[H+][OHー] = 1.0×10ー14
- これは水のイオン積の公式である。
\[ \mathrm{[H^{+}][OH^{-}]=1.0×10^{-14}} \]
④pH + pOH = 14
- この公式は③を変形することで導出できる。
\[ \begin{align}&\mathrm{[H^{+}][OH^{-}]=1.0×10^{-14}}\\
&\mathrm{↔-log_{10}[H^{+}][OH^{-}]=-log_{10}1.0×10^{-14}}\\
&\mathrm{↔-( log_{10}[H^{+}]+log_{10}[OH^{-}] )=14}\\
&\mathrm{↔-log_{10}[H^{+}]-log_{10}[OH^{-}]=14}\\
&\mathrm{↔pH+pOH=14} \end{align}\]
⑤[H+] = c×m×α
- 溶液のモル濃度cに価数m(酸がもっているH+の数)と電離度α(溶解している酸に対する、電離している酸の割合)をかけると、H+のモル濃度[H+]を求めることができる。
\[ \mathrm{[H^{+}]=c×m×α} \]
参考:【酸・塩基】価数(一覧・覚え方・例など)
参考:電離度(求め方・公式・酸/塩基の強弱との関係など)
⑥[OHー] = c×m×α
- 溶液のモル濃度cに価数m(塩基がもっているOHーの数)と電離度α(溶解している塩基に対する、電離している塩基の割合)をかけると、OHーのモル濃度[OHー]を求めることができる。
\[ \mathrm{[OH^{-}]=c×m×α} \]
強酸のpHの求め方
- 強酸のpHの求め方を、例題を解きながら解説する。
1.0×10ー2(mol/L)の塩酸のpHを求めよ。ただし、塩酸の電離度は1とする。(有効数字2桁で解答)
まずは、[H+]=c×m×αの公式を使って、[H+]を求める。
\[ \begin{align} \mathrm{[H^{+}]} &\mathrm{= 1.0×10^{-2}×1×1} \\
&\mathrm{= 1.0×10^{-2}} \end{align} \]
次に、pH=ーlog[H+]の公式を使って、pHを求める。
\[ \begin{align} \mathrm{pH}&\mathrm{=-log(1.0×10^{-2})} \\
&\mathrm{= 2.0} \end{align} \]
弱酸のpHの求め方
- 弱酸のpHの求め方を、例題を解きながら解説する。
0.10×10ー3(mol/L)の酢酸のpHを求めよ。ただし、酢酸の電離度は0.01とする。(有効数字2桁で解答)
まずは、[H+]=c×m×αの公式を使って、[H+]を求める。
\[ \begin{align} \mathrm{[H^{+}]}&\mathrm{=0.10×10^{-3} × 1 × 0.01} \\
&\mathrm{=1.0×10^{-6}} \end{align} \]
次に、pH=ーlog[H+]の公式を使って、pHを求める。
\[ \begin{align} \mathrm{pH}&\mathrm{=-log(1.0×10^{-6})} \\
&\mathrm{=6.0} \end{align} \]
強塩基のpHの求め方
- 強塩基のpHの求め方を、例題を解きながら解説する。
1.0×10ー2(mol/L)の水酸化ナトリウム水溶液のpHを求めよ。ただし、水酸化ナトリウムの電離度は1とする。(有効数字2桁で解答)
まずは、[OHー]=c×m×αの公式を使って、[OHー]を求める。
\[ \begin{align} \mathrm{[OH^{-}]}&\mathrm{=1.0×10^{-2}×1×1}\\
&\mathrm{=1.0×10^{-2}} \end{align} \]
次に、[H+][OHー]=1.0×10ー14の公式を使って、[H+]を求める。
\[ \begin{align}\mathrm{ [H^{+}]}&\mathrm{=\frac{ 1.0×10^{-14} }{ [OH^{-}] }}\\
&\mathrm{=\frac{ 1.0×10^{-14} }{ 1.0×10^{-2} }}\\
&\mathrm{=1.0×10^{-12}}\end{align} \]
最後に、pH=ーlog[H+]の公式を使って、pHを求める。
\[ \begin{align} \mathrm{pH}&\mathrm{=-log(1.0×10^{-12})}\\
&\mathrm{=12} \end{align} \]
希釈溶液のpH計算
- 希釈溶液とは元々あった溶液を薄めた溶液である。
- pHの計算問題では、この希釈溶液の関連の問題がよく出題されるため、解き方をきちんと定着させておこう。
1.0×10ー2(mol/L)の塩酸HCl1.0mlに水を加え、全体で100mlとした。このときのpHを求めよ。ただし、HClの電離度は1とする。(有効数字2桁で解答)
まずは、希釈前のmolを求める。
\[ \mathrm{1.0×10^{-2}(mol/L) × \frac{ 1 }{ 1000 }(L) = 1.0×10^{-5}(mol)} \]
次に、STEP1で求めたmolをLで割ることにより、濃度を導き出す。
そのmolを、希釈後のLで割ることでモル濃度(mol/L)を求める。
\[ \mathrm{\frac{ 1.0×10^{-5}(mol) }{ \displaystyle \frac{ 100 }{ 1000 }(L) } = 1.0×10^{-4}(mol/L)} \]
次に、[H+]=c×m×αの公式を使って、[H+]を求めていく。
\[ \begin{align} \mathrm{[H^{+}]}&\mathrm{=1.0×10^{-4} ×1×1}\\
&\mathrm{=1.0×10^{-4}} \end{align} \]
次に、pH=ーlog[H+]の公式を使って、pHを求めていく。
\[ \begin{align}\mathrm{ pH}&\mathrm{=-log(1.0×10^{-4})}\\
&\mathrm{=4.0} \end{align} \]
混合溶液のpH計算
- 混合溶液とは複数の溶液を混ぜてできる溶液である。
- 混合溶液のpH計算も、希釈溶液のpH計算同様入試頻出なので、解き方をきちんと定着させておこう。
1.0×10−2(mol/L)の塩酸HCI 10mlに、1.0×10−3(mol/L)の水酸化ナトリウムNaOH水溶液10mLを加えた。このときのpHを求めよ。ただし、log104.5=0.65とする。
まずは、HClから生じるH+、NaOHから生じるOHーのmolをそれぞれ求める。
HClから生じるH+
\[ \begin{align}\mathrm{H^{+}}&\mathrm{=1.0×10^{-2}(mol/L)×\frac{ 10 }{ 1000 }(L)×1}\\
&\mathrm{=1.0×10^{-4}(mol)} \end{align} \]
NaOHから生じるOHー
\[ \begin{align}\mathrm{OH^{-}}&\mathrm{=1.0×10^{-3}(mol/L)×\frac{ 10 }{ 1000 }(L)×1}\\
&\mathrm{=1.0×10^{-5}(mol) }\end{align} \]
次に、STEP1で求めたmol同士で引き算することで、中和で余ったH+(またはOHー)のmolを求める。
\[ \underbrace{ 1.0×10^{-4}}_{ \mathrm{HClから出たH^{+}} } – \underbrace{ 1.0×10^{-5}}_{ \mathrm{NaOHから出たOH^{-}} }
=\underbrace{ 9.0×10^{-5}}_{ \mathrm{余ったH^{+}} } \]
次に、STEP2で求めたmolをLで割ることにより、H+の濃度を導き出す。
\[ \mathrm{\frac{ 9.0×10^{-5}(mol) }{ \displaystyle \frac{ 10+10 }{ 1000 }(L) } = 4.5×10^{-3}(mol/L)} \]
最後に、pH=ーlog[H+]の公式を使って、pHを求める。
\[ \begin{align} \mathrm{pH}&\mathrm{=-log(4.5×10^{-3})}\\
&=2.35\\
&≒2.4 \end{align} \]











