MENU
電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)
目次
はじめに
【プロ講師解説】このページでは『電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)』について解説しています。
電子親和力とは
- 原子に電子1個をくっつけたときに放出されるエネルギーを電子親和力という。
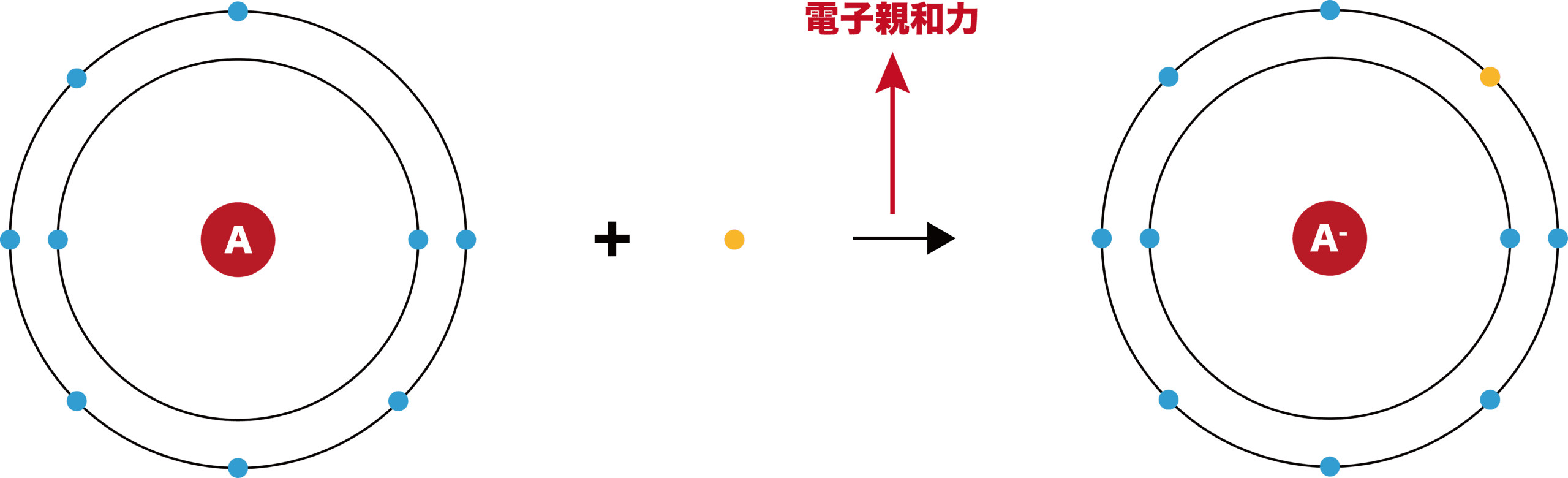

「力(ちから)」という文字がありますが、これは「エネルギー」と同じ意味をもちます。
電子親和力はイオン化エネルギーと対比して聞かれることが多いので、次のページも必ず確認しておきましょう。
参考:イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
電子親和力=電子との仲の良さ
- 前述の通り、電子親和力とは、原子に電子1個をくっつけたときに放出されるエネルギーである。
- 電子親和力はイオン化エネルギーなどと比べてイメージしづらいが、「電子親和力=電子との仲の良さ」と考えると理解しやすい。
- 電子親和力が大きい場合、電子と仲がいい。電子と仲がいいということは、電子を他から奪う力が強い。一方、電子親和力が小さい場合、電子と仲が良くない。仲が良くないということは、電子を他から奪う力が弱い。
- このように考えると(イオン化エネルギーを”防御力の指標”対応させて)電子親和力はその原子の”攻撃力の指標”と見ることができる。
●電子親和力 大
電子と仲がいい → 他から電子を奪いやすい → 攻撃力 高
●電子親和力 小
電子と仲が悪い → 他から電子を奪いにくい → 攻撃力 低
「原子に電子1個をくっつけたときに電子親和力が放出される」という反応は発熱反応です。電子親和力は電子をくっつけるときに「放出」されるエネルギー(熱)なので、熱を放出する反応、つまり発熱反応となります。
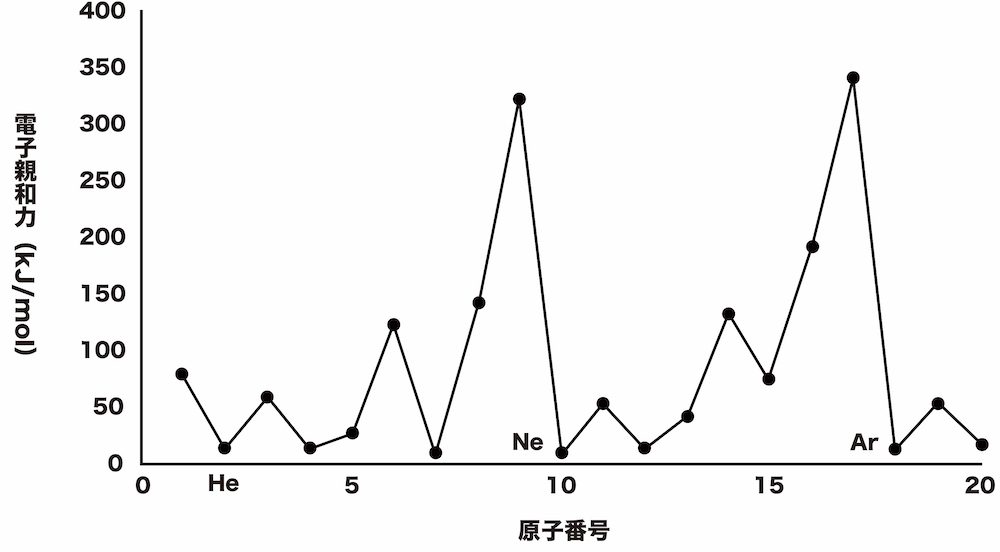
電子親和力の周期表中での傾向
- 周期表上で、電子親和力は規則的な変化をしている。

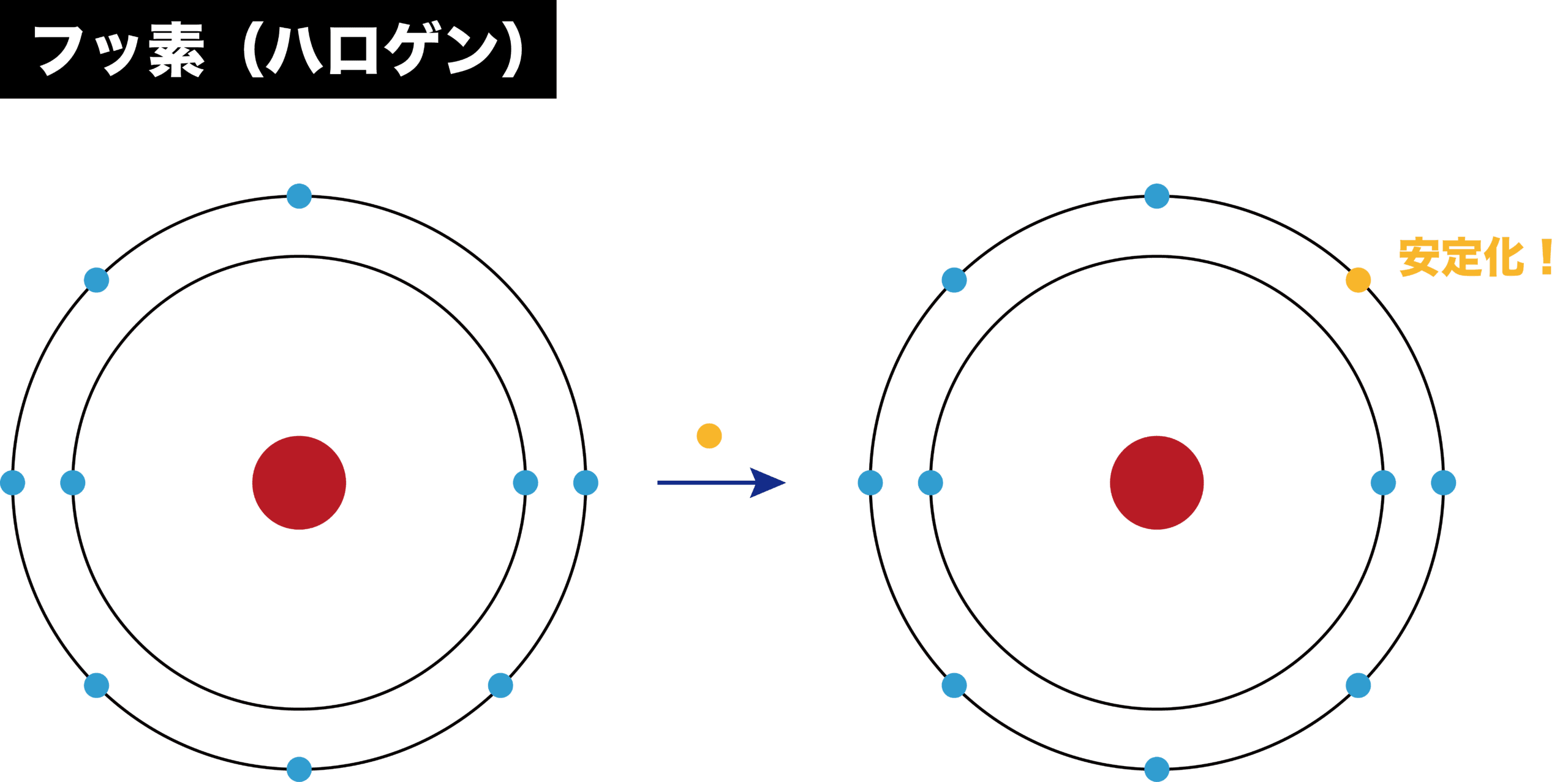
ハロゲン
- ハロゲンの電子親和力は大きい。これは、ハロゲンにあと1個電子が入れば、安定な希ガスの電子配置になるためである。
- 例えばフッ素Fでは、最外殻であるL殻に1個電子が入ると、希ガスのネオンNeの電子配置となり、安定化する。

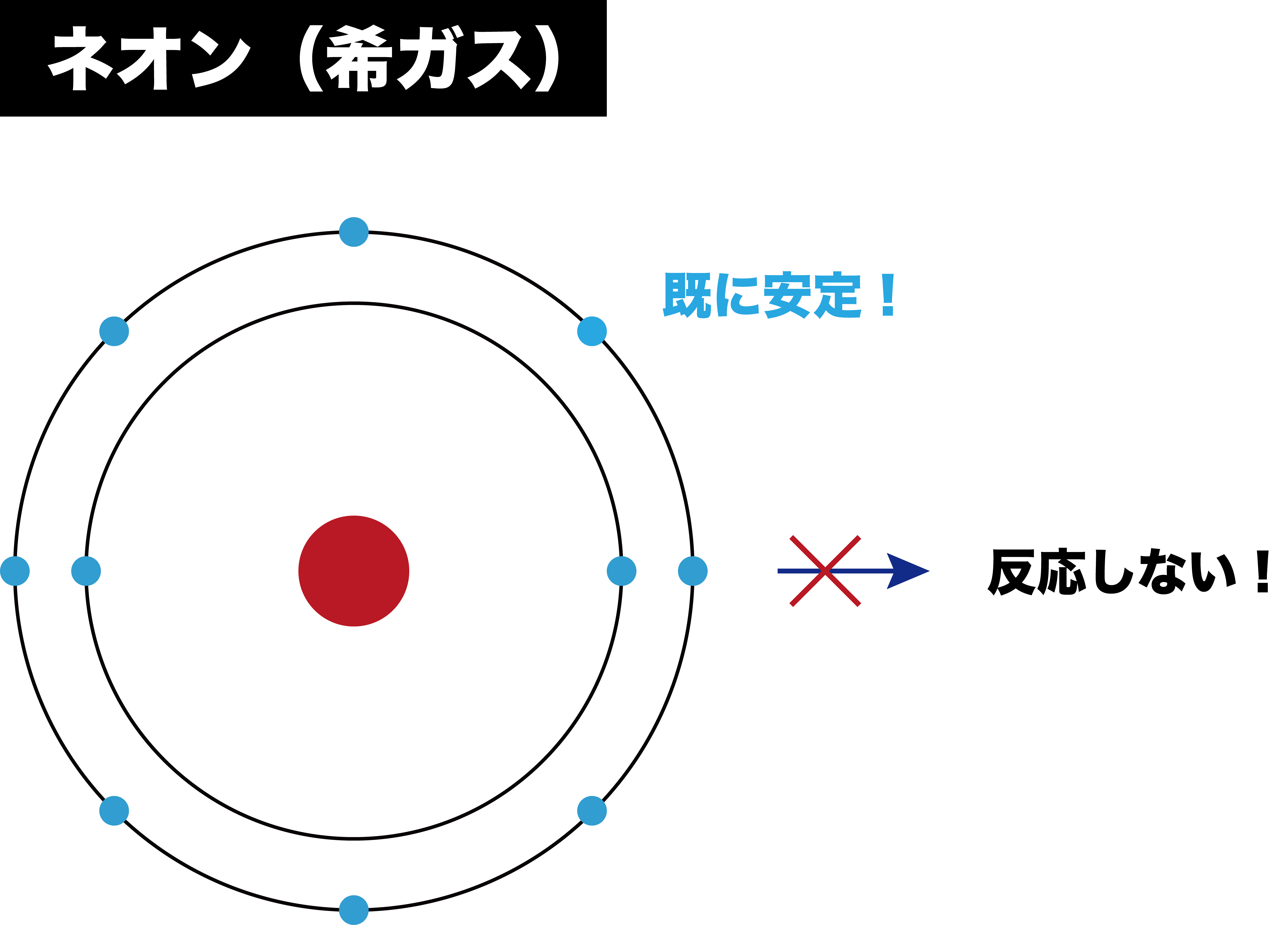
希ガス
- 希ガスの電子親和力は小さい。
- これは、希ガスは最外殻が閉殻もしくはオクテットの状態で非常に安定しており、外から電子をもってこようとしないためである。
- 例えばネオンNeでは、最外殻であるL殻が閉殻であり、安定している。

電子親和力まとめ
この『電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)』のページで解説した内容をまとめる。
- 原子に電子1個をくっつけたときに放出されるエネルギーを電子親和力という。
- ●電子親和力 大
電子と仲がいい → 他から電子を奪いやすい → 攻撃力 高
●電子親和力 小
電子と仲が悪い → 他から電子を奪いにくい → 攻撃力 低 - 「原子に電子1個をくっつけたときに電子親和力が放出される」という反応は発熱反応である。
- ハロゲンの電子親和力は大きい。これは、ハロゲンにあと1個電子が入れば、安定な希ガスの電子配置になるためである。
- 希ガスの電子親和力は小さい。これは、希ガスは最外殻が閉殻もしくはオクテットの状態で非常に安定しており、外から電子をもってこようとしないためである。
参考:貴ガス(希ガス)の電子配置が安定な理由











