MENU
モル濃度計算の解き方(公式・希釈時の濃度・密度や質量パーセント濃度との変換など)
はじめに
【プロ講師解説】このページでは『モル濃度計算の解き方(公式・希釈時の濃度・密度や質量パーセント濃度との変換など)』について解説しています。
モル濃度とは・公式
- 溶質の物質量molを溶液の体積Lで割って得られる濃度をモル濃度という。
- モル濃度の単位はmol/Lである。
\[ \mathrm{モル濃度(mol/L) = \frac{ 溶質(mol) }{ 溶液(L) }} \]
- ちなみに、溶液・溶質というのがそれぞれ何を指すのかは正確に理解しておこう。
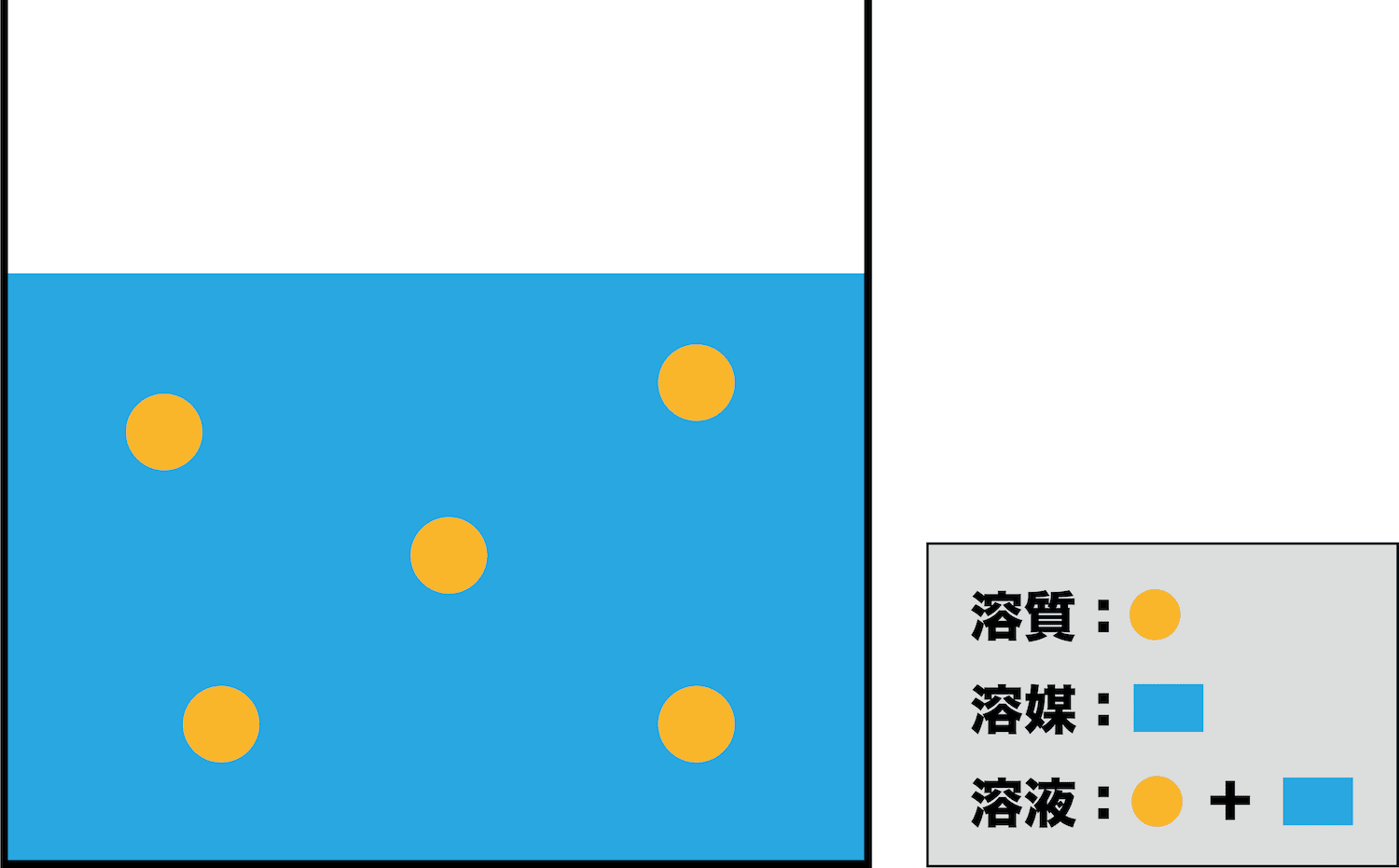

- 溶けている物質を溶質、溶質を溶かしている液体を溶媒、溶媒と溶質を合わせたものを溶液という。
モル濃度の計算解法
- モル濃度は基本的には上で紹介した公式に溶質のmol、溶液のLを代入すれば求めることができる。
\[ \mathrm{モル濃度(mol/L) = \frac{ 溶質(mol) }{ 溶液(L) }} \]
2.0molの水酸化ナトリウムNaOHを水に溶かして全体で4.0Lにしたときのモル濃度mol/Lを求めよ。
- 公式に当てはめると次のようになる。
\[ \begin{align} \mathrm{モル濃度(mol/L) }&=\mathrm{\frac{ 溶質(mol) }{ 溶液(L) }} \\
&=\mathrm{\frac{ 2.0(mol) }{ 4.0(L) }} \\
&\mathrm{≒0.50(mol/L) }\end{align} \]
- 毎回このように出題してくれれば簡単だけど、実際はもう少しひねった問題が出されることが多い。
- 次はやや応用の「gとLが与えられている場合」のモル濃度計算について説明していこう。
モル濃度計算でgとLが与えられている場合
- 先ほどの例題ではmolとLが与えられていたが、gとLが与えられていて、そこからモル濃度を求めていく問題も出されることがある。
4.0gの水酸化ナトリウムNaOHを水に溶かして全体で2.0Lにしたときのモル濃度mol/Lを求めよ。
- この場合でもモル濃度を求める公式として次のものを使うことは変わらない。
\[ \mathrm{モル濃度(mol/L) = \frac{ 溶質(mol) }{ 溶液(L) } }\]
- この公式の分母であるLは既に問題で与えられており、代入するだけ。分子の部分は少し工夫をした計算をする必要がある。


- gを分子量g/molで割ることでmolを導き出している。
希釈時のモル濃度を使った計算
- 希釈時のモル濃度を使った計算として次の2パターンが有名である。
【パターン1】モル濃度のわかっている溶液を薄めたときのモル濃度を求める問題
【パターン2】つくりたい溶液のモル濃度が与えられており、それをつくるのに何mLの水で薄めればいいかを求める問題
- この2パターンの問題の解法について、順番に解説する。
【パターン1】モル濃度のわかっている溶液を薄めたときのモル濃度を求める問題
- まずはじめに、モル濃度の希釈に関する問題を解く上で必ず知っておかなければいけないことを説明する。
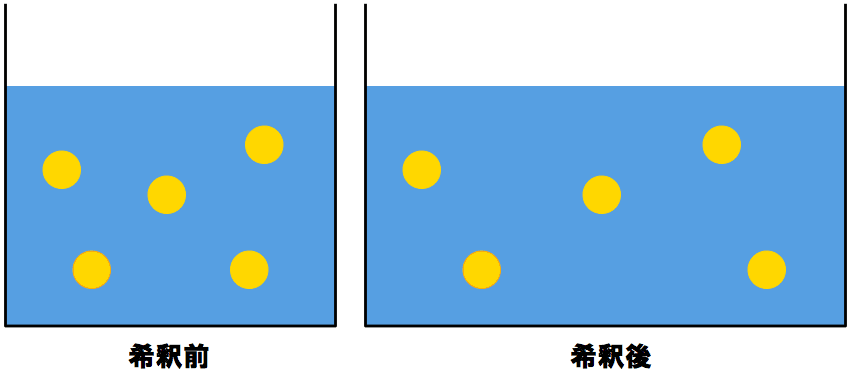
希釈前と希釈後の「mol」は変わらない
- 溶液を希釈する前と希釈した後の溶質のmol数は変わらない。
- これは、よく考えると当然。溶媒が増えて溶液が希釈されたとしても、溶質の量自体は変化しない。

- 前提としてこれを理解しておくと、次のような公式をつくることができる。
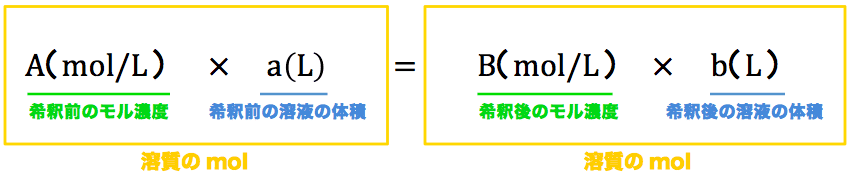

- モル濃度mol/Lと溶液の体積Lを掛けると(Lが約分されて)molが出てくる。
- このmolの数は、今説明したように反応前も反応後も変わらないから反応前のmol数と反応後のmol数をイコールで繋いでいる。それでは例題を解いていこう。
モル濃度が0.60mol/Lのグルコース水溶液300mLに、水を加えて900mLにした。この溶液のモル濃度を求めよ。
- 問題文に書かれている「希釈前のモル濃度」・「希釈前の溶液の体積」・「希釈後の溶液の体積」を公式に代入すると、次のようになる。
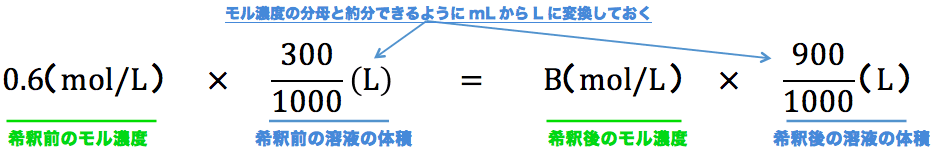

- これを解いて、B=0.20mol/Lとなる。
【パターン2】つくりたい溶液のモル濃度が与えられており、それをつくるのに何mLの水で薄めればいいかを求める問題
モル濃度1.8mol/Lの濃硫酸を希釈してモル濃度0.36mol/Lの希硫酸を4.0Lつくりたい。濃硫酸は何L必要か。
- このタイプの問題では「希釈前のモル濃度」・「希釈後のモル濃度」・「希釈後の溶液の体積」がわかっているので、これらを公式に代入する。
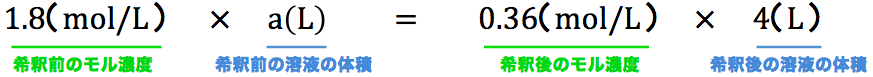
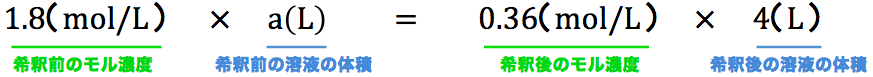
- これを解いて、a=0.80Lとなる。
モル濃度と密度・質量パーセント濃度の変換
- モル濃度と密度の関係を式で表すと次のようになる。
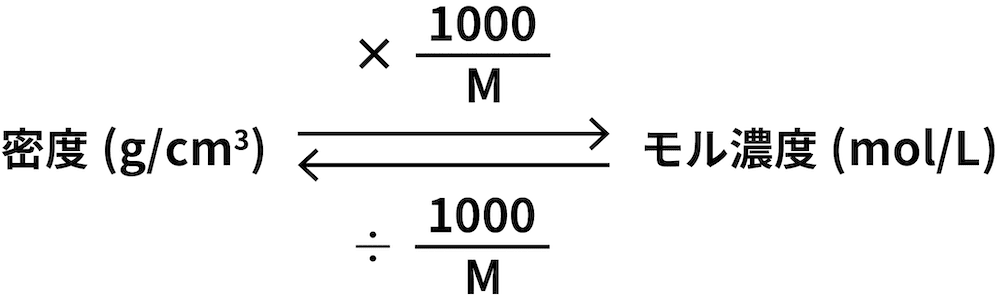

- 密度g/cm3に1000/M(Mは分子量g/molのこと)を掛けるとモル濃度mol/Lを、モル濃度を1000/Mで割ると密度g/cm3を求めることができる。ちなみに、この関係は次のように導き出されている。
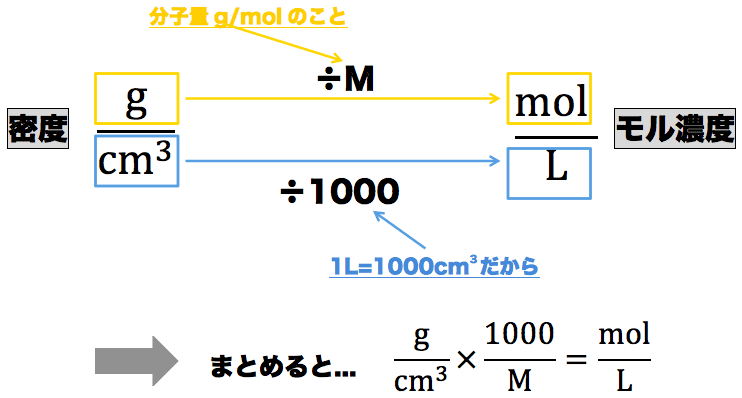

- それでは、この式を押さえた上で次の例題を解いてみよう。
質量パーセント濃度98%、密度1.84g/cm3の濃硫酸(分子量98)のモル濃度を求めよ。
- まずはじめに、密度と分子量を使って計算式を立てる。
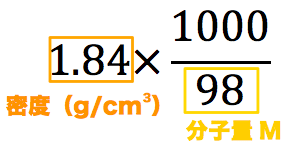
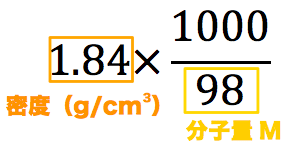
- 基本これを計算すれば終了だが、今回は質量パーセント濃度の記載があるのでそれを掛ける。
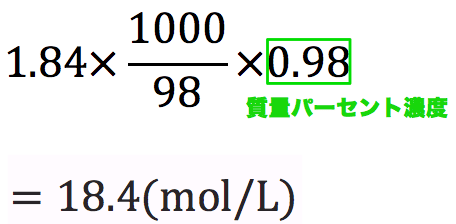
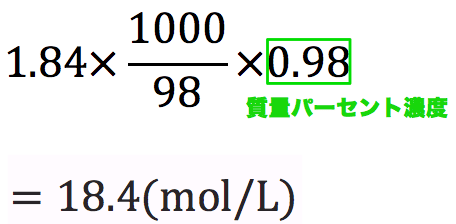
演習問題
1.0molの水酸化ナトリウムNaOHを水に溶かして全体で2.0Lにしたときのモル濃度mol/Lを求めよ。
解答/解説:タップで表示
解答:0.50mol/L
\[ \begin{align} \mathrm{モル濃度(mol/L) }&=\mathrm{\frac{ 溶質(mol) }{ 溶液(L) } }\\
&\mathrm{=\frac{ 1.0(mol) }{ 2.0(L) } }\\
&\mathrm{≒0.50(mol/L) }\end{align} \]
0.3molの塩化水素HClを水に溶かして全体で200mLにしたときのモル濃度mol/Lを求めよ。
解答/解説:タップで表示
解答:1.5mol/L
問題文に記載されているのはmLなので、それをLに直して計算する。
\[ \begin{align} \mathrm{モル濃度(mol/L)} &\mathrm{=\frac{ 溶質(mol) }{ 溶液(L) }} \\
&\mathrm{=\frac{ 0.30(mol) }{ \frac{ 200 }{ 1000 } } }\\
&\mathrm{≒1.5(mol/L)} \end{align} \]
2.0gの水酸化ナトリウムNaOHを水に溶かして全体で2.0Lにしたときのモル濃度mol/Lを求めよ。
解答/解説:タップで表示
解答:0.025mol/L
gが与えられているので、分子量g/molを使ってmolを導き出してから計算する。
\[ \begin{align} \mathrm{モル濃度(mol/L) }&\mathrm{=\frac{ 溶質(mol) }{ 溶液(L) } }\\
&\mathrm{=\frac{ \frac{ 2.0(g) }{ 40(g/mol) } }{ 2.0(L) }} \\
&\mathrm{≒0.025(mol/L) }\end{align} \]










