MENU
最外殻電子と価電子(違い・一覧・8個の理由など)
目次
はじめに
【プロ講師解説】このページでは『最外殻電子と価電子(違い・一覧・8個の理由など)』について解説しています。
最外殻電子
- 最も外側にある電子殻(最外殻)に存在する電子を最外殻電子という。
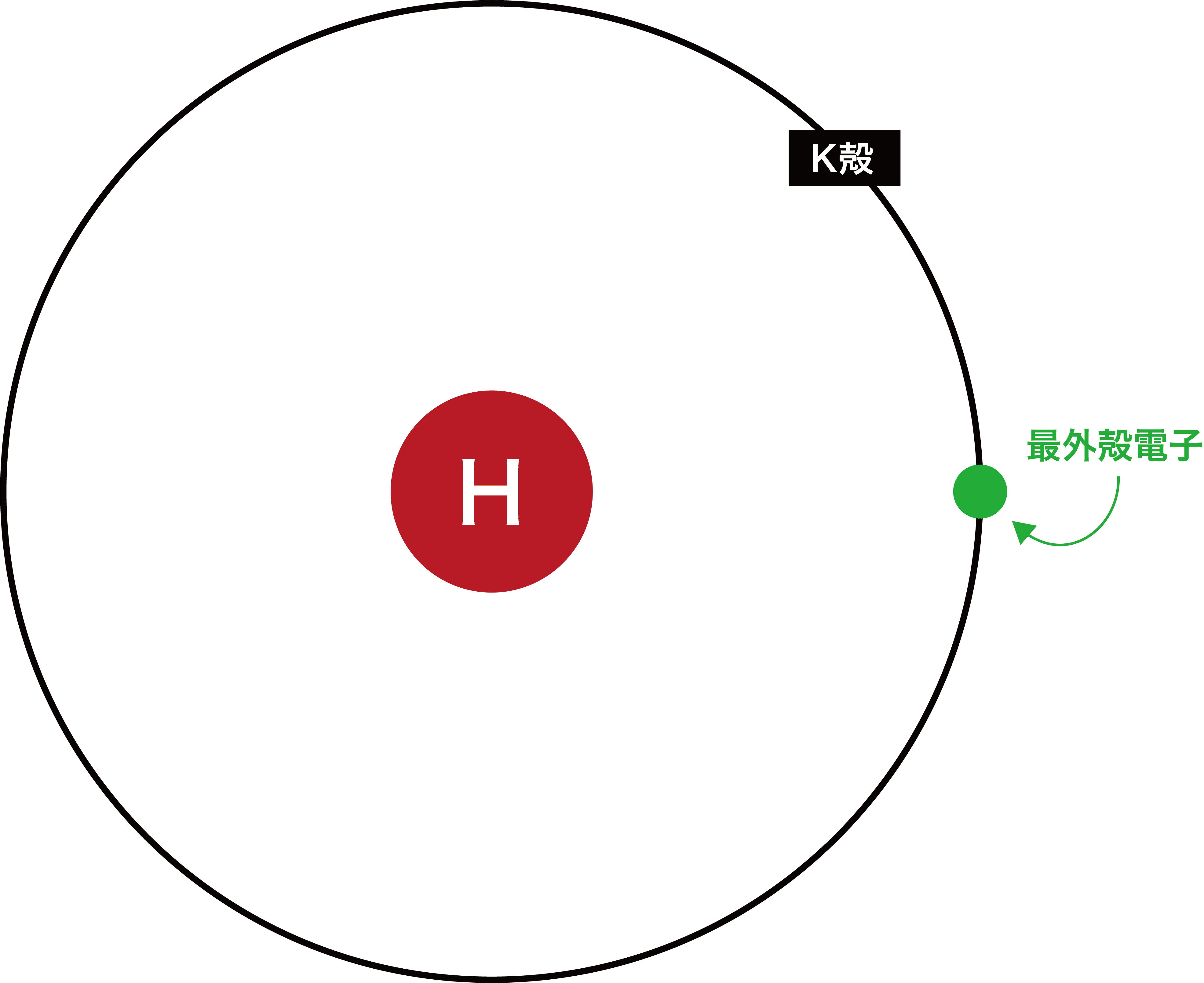
水素
- 水素の最外殻はK殻である。
- したがって、K殻に存在する1個の電子が最外殻電子である。

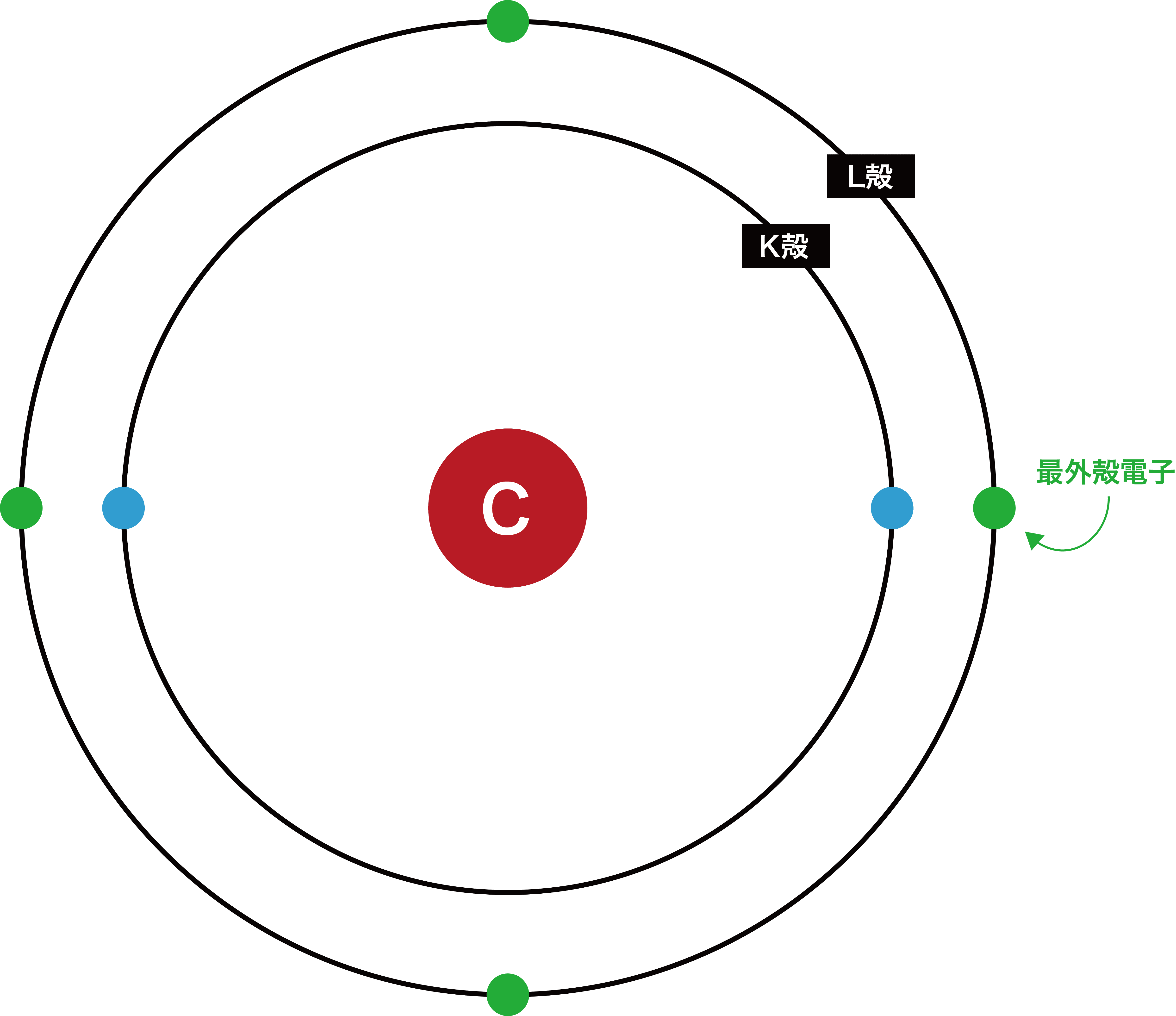
炭素
- 炭素炭素の最外殻はL殻である。
- したがって、L殻に存在する4個の電子が最外殻電子である。

価電子
- 最外殻電子のうち、反応に使われる電子を価電子という。
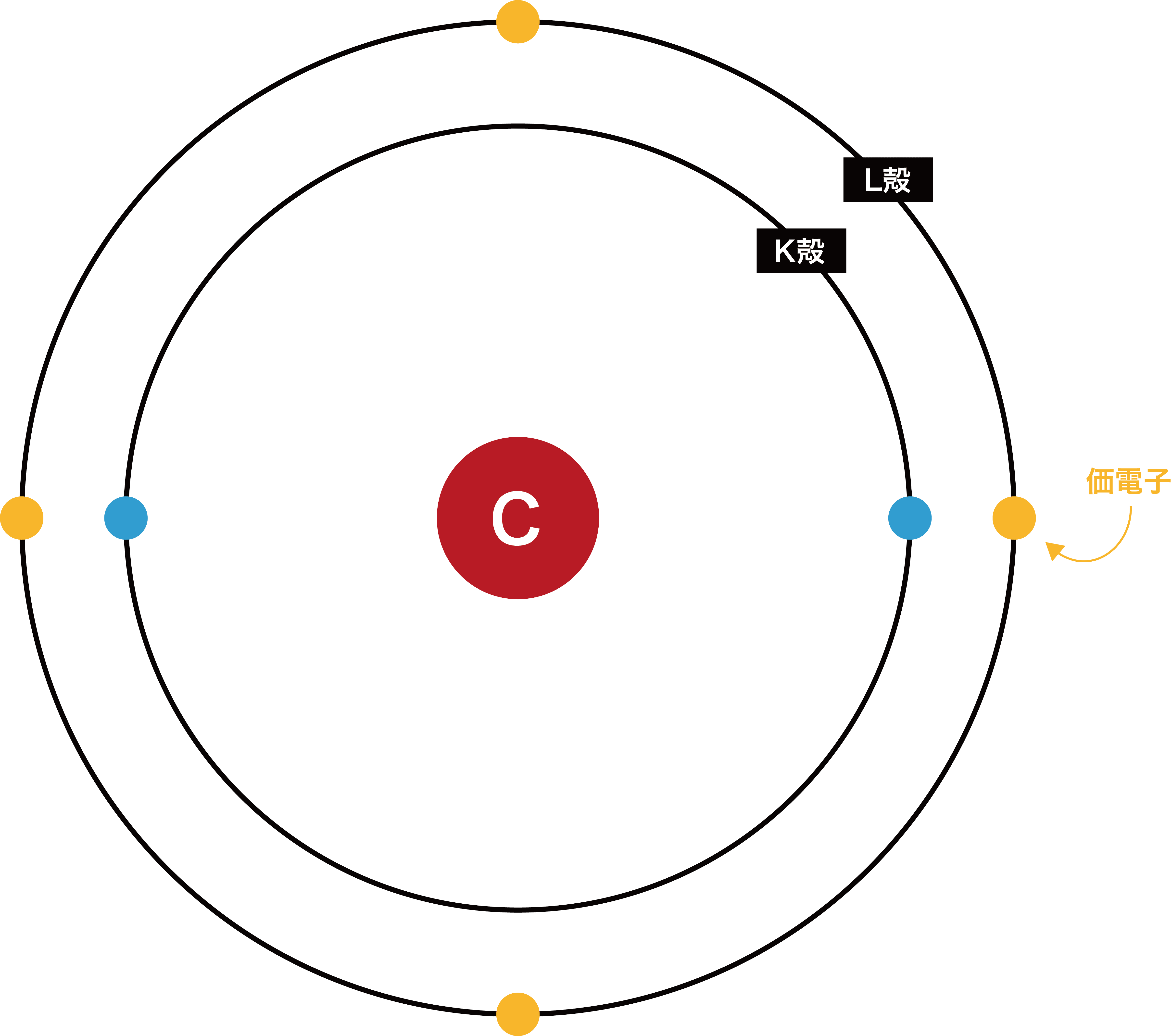

- 原子のもつ電子のうち、他原子との反応に使われるのは最も外側に存在する電子である。
- したがって、多くの場合、価電子は最外殻電子とイコールになる。
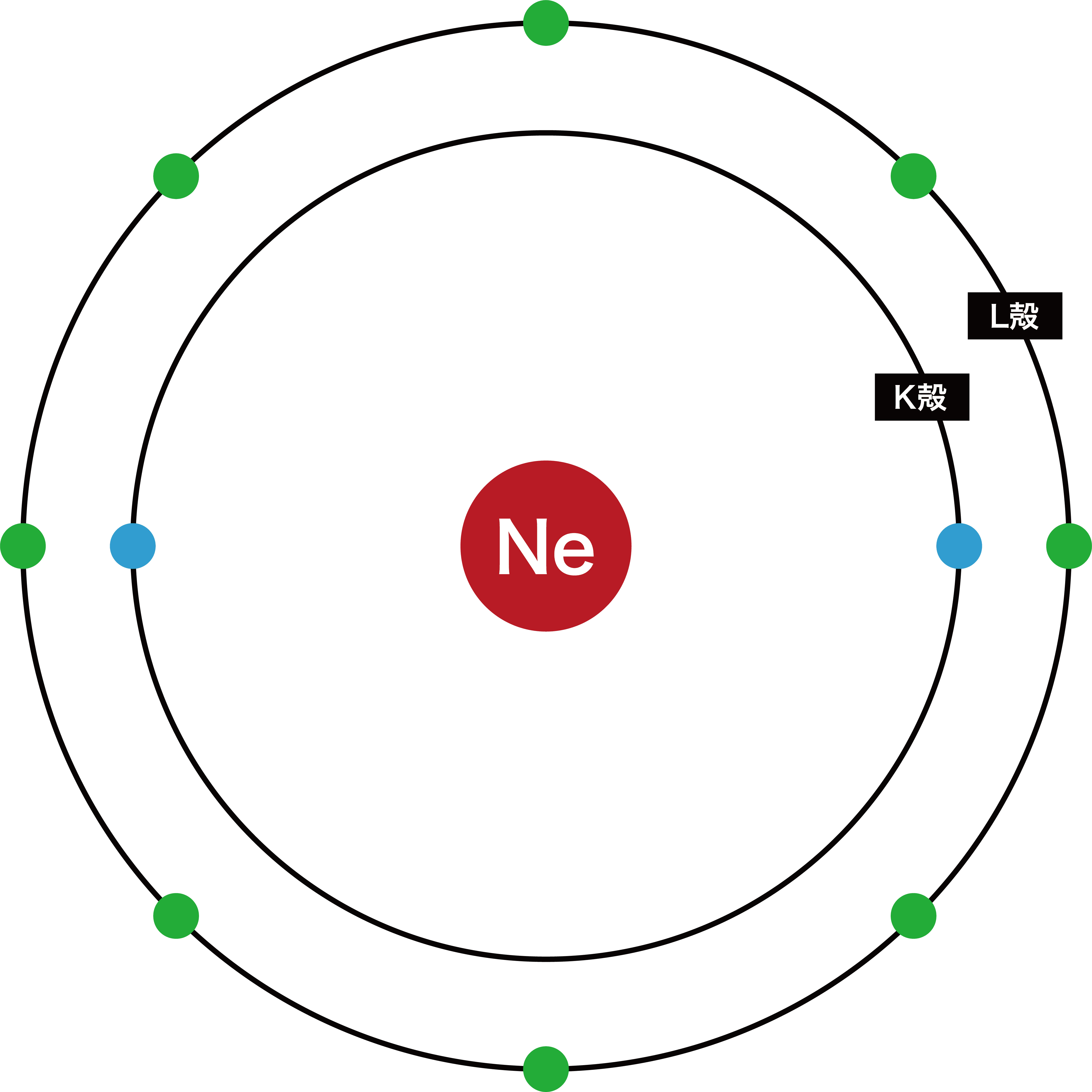
最外殻電子数一覧
- 代表的な原子の最外殻電子数を一覧で示す。
| 原子 | 最外殻電子数 |
|---|---|
| リチウムLi | 1 |
| ベリリウムBe | 2 |
| ホウ素B | 3 |
| 炭素C | 4 |
| 窒素N | 5 |
| 酸素O | 6 |
| フッ素F | 7 |
| ネオンNe | 8 |
最外殻電子・価電子まとめ
この『最外殻電子と価電子(違い・一覧・8個の理由など)』のページで解説した内容をまとめる。
- 最も外側にある電子殻(最外殻)に存在する電子を最外殻電子という。
- 反応に使われる電子を価電子という。
- 希ガスの最外殻電子は反応に使われない。したがって、希ガスの価電子数は0である。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
最も外側の電子殻を【1】という。
解答/解説:タップで表示
解答:【1】最外殻
最も外側の電子殻を最外殻という。
問2
最外殻に存在する電子を【1】という。
解答/解説:タップで表示
解答:【1】最外殻電子
最外殻に存在する電子を最外殻電子という。
問3
ヘリウムの最外殻電子数は【1】個、ネオン以降の貴ガスの最外殻電子数は【2】個である。
解答/解説:タップで表示
解答:【1】2【2】8
ヘリウムの最外殻電子数は2個、ネオン以降の貴ガスの最外殻電子数は8個である。
問4
最外殻電子のうち、原子同士の結合に関与する電子を【1】という。
解答/解説:タップで表示
解答:【1】価電子
最外殻電子のうち、原子同士の結合に関与する電子を価電子という。
問5
希ガスの価電子数は【1】個である。
解答/解説:タップで表示
解答:【1】0
希ガスの価電子数は0個である。