MENU
電気分解(原理・反応式・電池との関係など)
目次
はじめに
【プロ講師解説】このページでは『電気分解(原理・反応式・電池との関係など)』について解説しています。
電気分解とは
- 炭素C電極を使って塩化銅CuCl2水溶液に電気刺激を与えると、陰極では単体の銅Cuが析出し、陽極では気体の塩素Cl2が発生する。
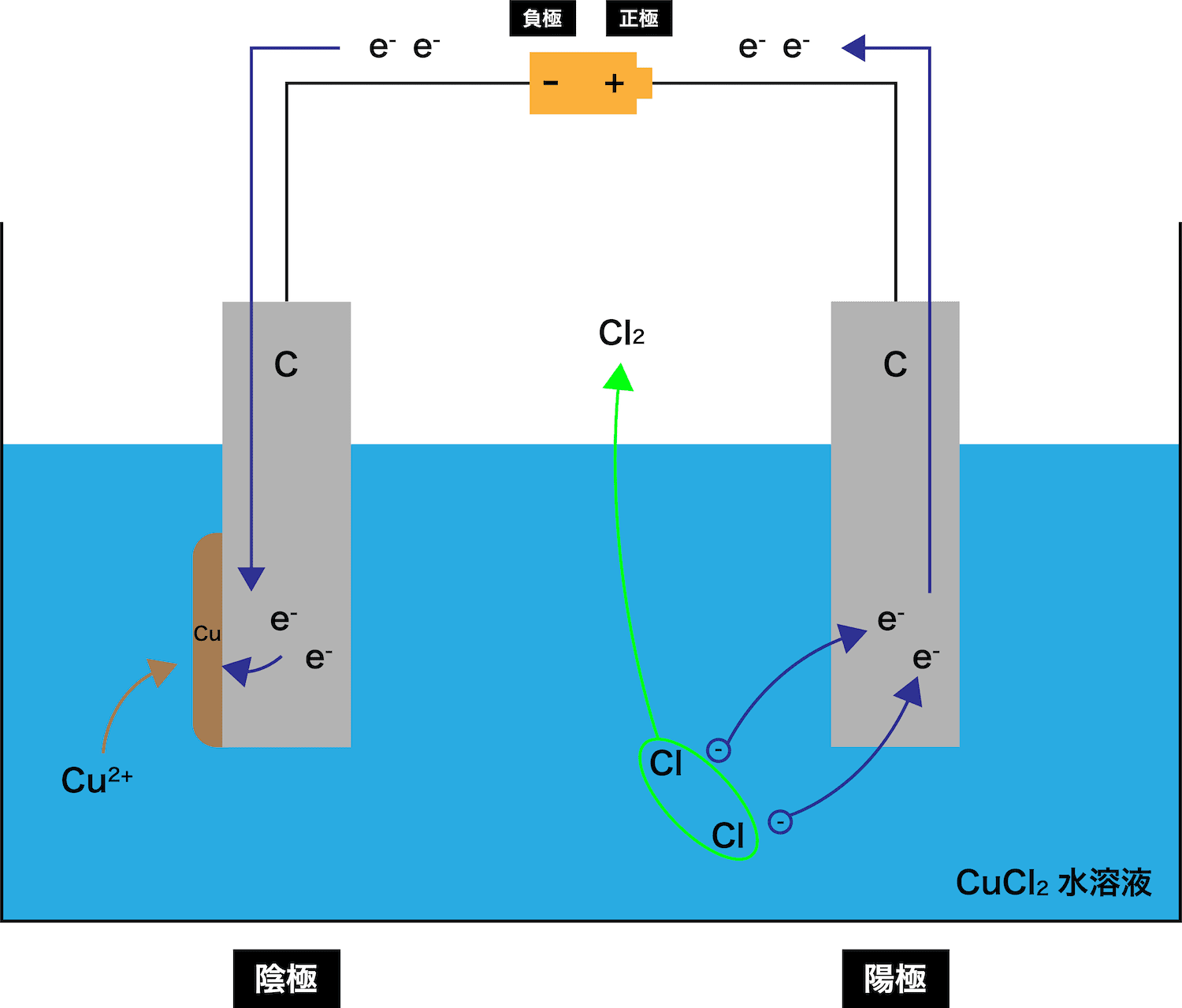


- このように、外部から電気刺激を与えることで、ある物質(この例ではCuCl2)を分解することを電気分解という。
電気分解の仕組み
- 電気分解の仕組みについて、次の3STEPで解説する。
●STEP1
電池の負極から電子eーが出てくる。
●STEP2
陰極で溶液中の陽イオンがeーを受け取る
→ 単体として析出
●STEP3
【パターン1】陽極板がAu/Pt/Cの場合
陽極で陰イオンがeーを離す
→ eーを失った陰イオンは単体になる(e–は電池の正極に戻っていく)
【パターン2】陽極板がAu/Pt/C以外の場合
陽極板が溶ける
→ 陽イオンとなり溶液中へ(eーは電池の正極に戻っていく)
- ここでは例として「塩化銅CuCl2水溶液の電気分解」を用いる。
STEP
電池の負極から電子eーが出てくる。
まず、電池の負極から電子eーが出てくる。
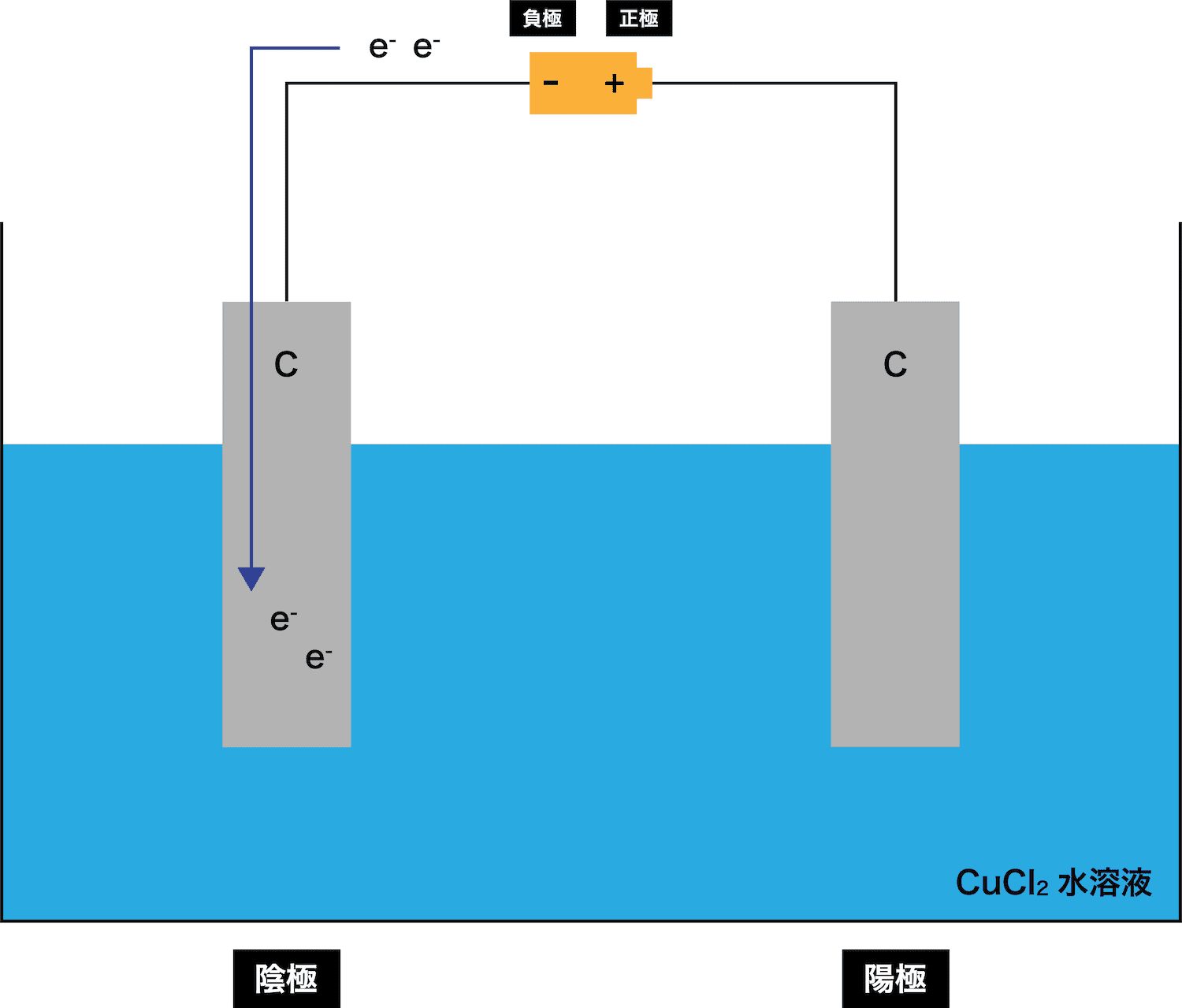

STEP
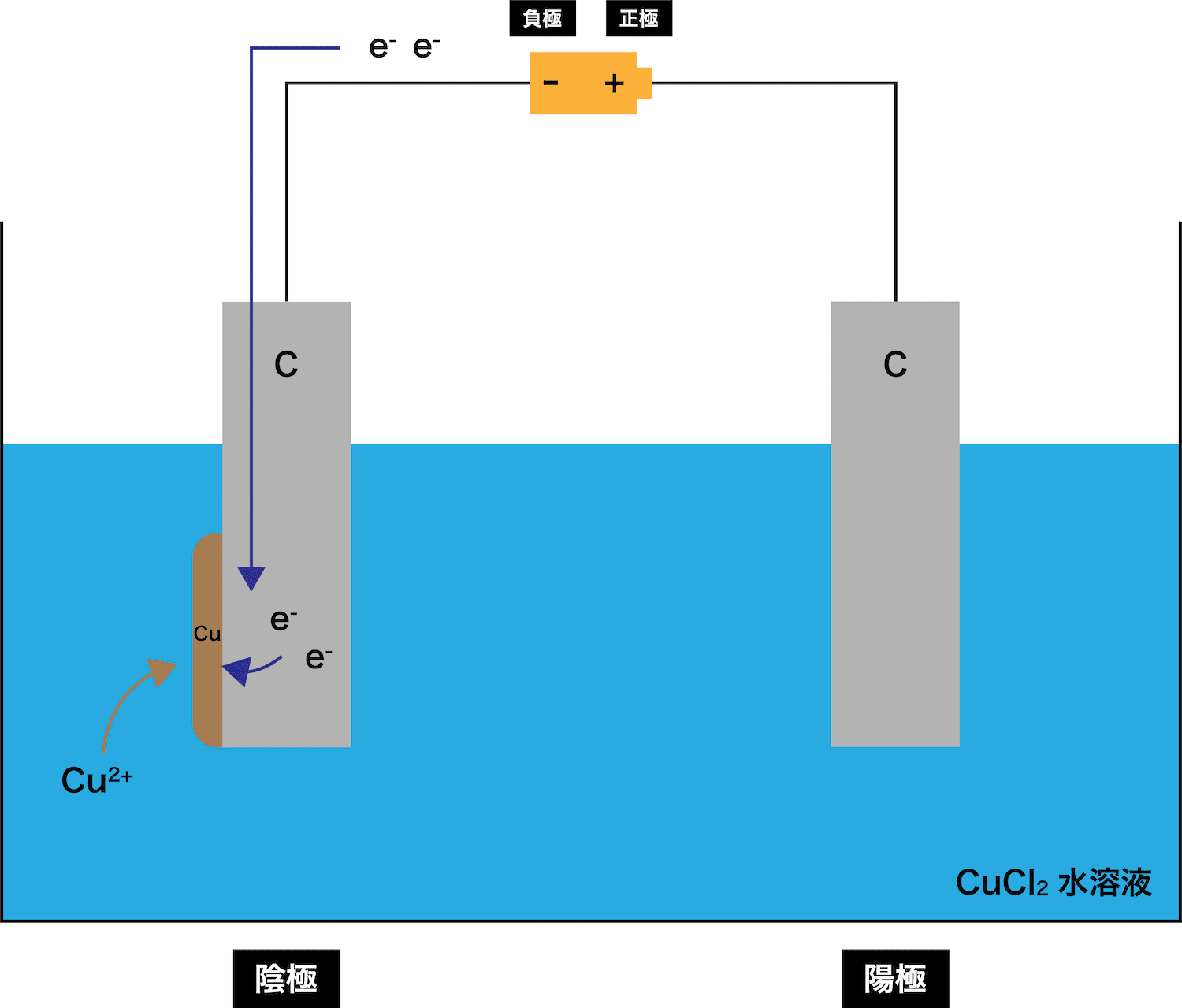
陰極で溶液中の陽イオンがeーを受け取る
→ 単体として析出
→ 単体として析出
次に、陰極で溶液中のCu2+がeーを受け取り、単体のCuが析出する。

よくある質問
- 次のような質問をよく受ける。
「水溶液中には陽イオンであるH+もいるはずなのに、なぜCu2+だけが電子を受け取るの?」
- CuCl2水溶液中には、水H2Oから電離したH+も存在している。しかし、H+とCu2+のイオン化傾向(=イオンでいたい度合い)を比べると、Cu2+の方が小さい。したがって、より「イオンでいたい」と思っているH+は溶液中にイオンとして残り、「別にイオンじゃなくてもいい」と思っているCu2+が電子を受け取り、単体として析出する。「(陽イオンでは)イオン化傾向の小さいイオンが電子を受け取る」ということを覚えておこう。
STEP
【パターン1】陽極板がAu/Pt/Cの場合
陽極で陰イオンがeーを離す
→ eーを失った陰イオンは単体になる(eーは電池の正極に戻っていく)
陽極で陰イオンがeーを離す
→ eーを失った陰イオンは単体になる(eーは電池の正極に戻っていく)
陽極での反応は、電極の素材で2パターンに分けることができる。
極板が金Auや白金Pt、炭素Cのときは「パターン1」、それ以外(CuやAgなど)の場合は「パターン2」となる。



今回の極板は炭素Cなので「パターン1」の方。
陰イオンであるClーはeーを離すと、気体のCl2として外に出ていく。
一方、eーは電池の正極へと戻っていく。
よくある質問
- 次のような質問をよく受ける。
「CuCl2水溶液中には、水H2Oから電離した陰イオンOHーも存在しているのに、なぜClーだけが電子を離すの?」
- この疑問は、陽イオンのときと同じ考え方で解決できる。Clーのイオン化傾向(=イオンでいたい度合い)はOHーと比べて小さい。したがって、「別にイオンじゃなくてもいい」と思っているClーの方が電子を離し、Cl2となる。「(陰イオンでは)イオン化傾向の小さいイオンが電子を離す」ということを覚えておこう。
各極の反応
- 上で挙げた「塩化銅CuCl2の電気分解」について、陰極・陽極での反応をそれぞれまとめる。
陰極
- 塩化銅CuCl2の電気分解の陰極では、電池の負極から流れてきたeーをCu2+が受け取り、単体のCuが析出する。
\[ \mathrm{Cu^{2+} + 2e^{-} → Cu} \]
陽極
- 塩化銅CuCl2の電気分解の陽極では、Clーが電子を離し、気体のCl2となる。
\[ \mathrm{2Cl^{-} → Cl_{2} + 2e^{-} }\]









