MENU
燃料電池(リン酸型・アルカリ型の仕組み、各極の反応式など)
はじめに
【プロ講師解説】このページでは『燃料電池(リン酸型・アルカリ型の仕組み、原理、各極の反応式など)』について解説しています。
燃料電池とは
- 水素などの燃料や空気中の酸素を用い、電気エネルギーを得る電池を燃料電池という。
- 高校化学で登場する主な燃料電池は「リン酸型燃料電池」と「アルカリ型燃料電池」の2種類である。
リン酸型燃料電池
- リン酸H3PO4水溶液を電解液とする燃料電池をリン酸型燃料電池という。
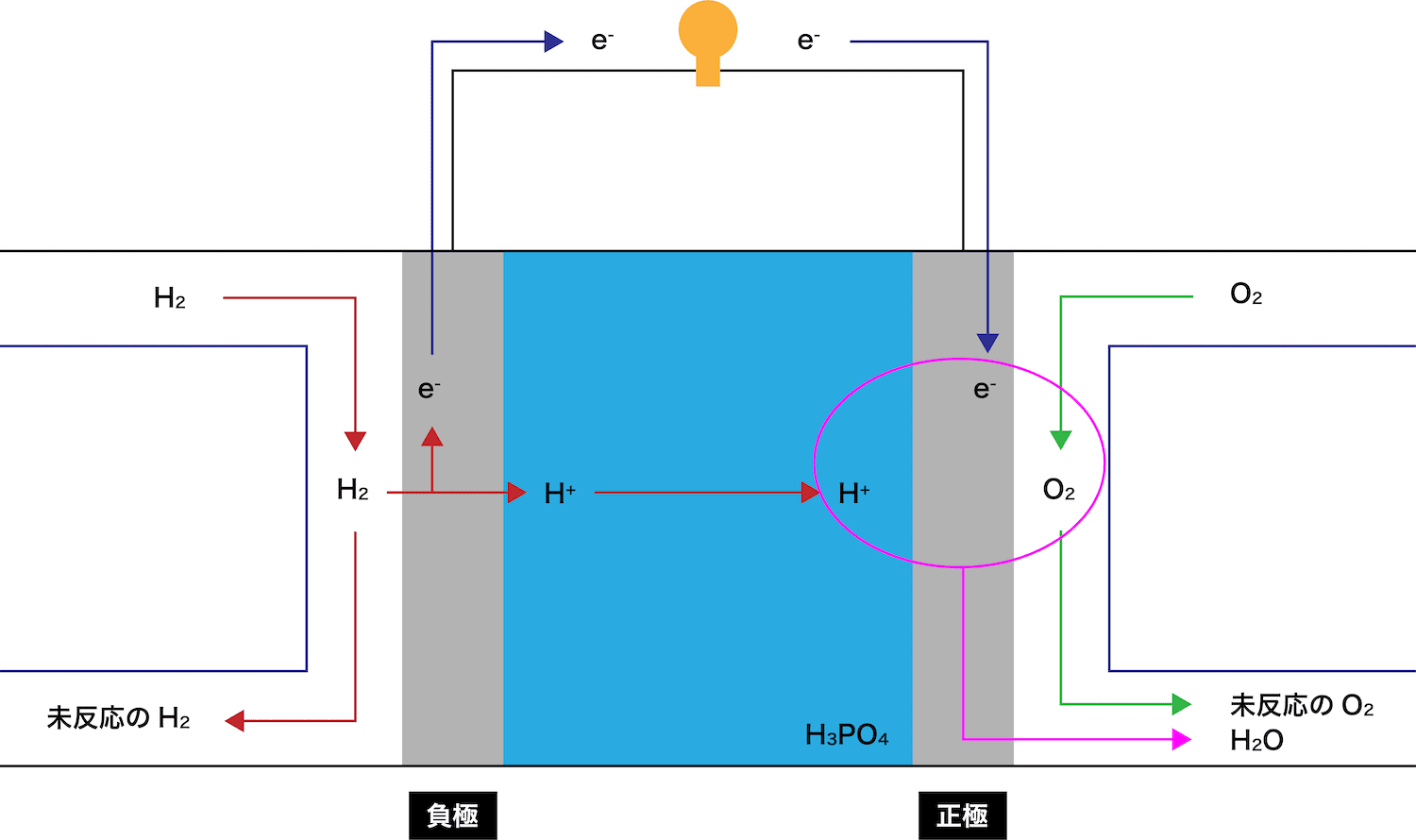


- リン酸型燃料電池は車両電源や発電用などとして、数多くの種類が開発された。
リン酸型燃料電池の電池式
- 先述の通り、リン酸型燃料電池は、リン酸H3PO4水溶液を電解液とする燃料電池である。
- これを踏まえて、リン酸型燃料電池の電池式は次のように表すことができる。
\[ \mathrm{(-)H_{2}|H_{3}PO_{4}aq|O_{2}(+) }\]
リン酸型燃料電池の仕組み
- リン酸型燃料電池の仕組みについて、次の3STEPで解説する。
●STEP1
負極で、水素H2が電子eーを離して水素イオンH+となる。
●STEP2
放出されたeーとH+はそれぞれ正極側に伝わっていく。
●STEP3
正極で、酸素O2がこれらと反応し水H2Oが生成する。


余ったH2は外に排出される。
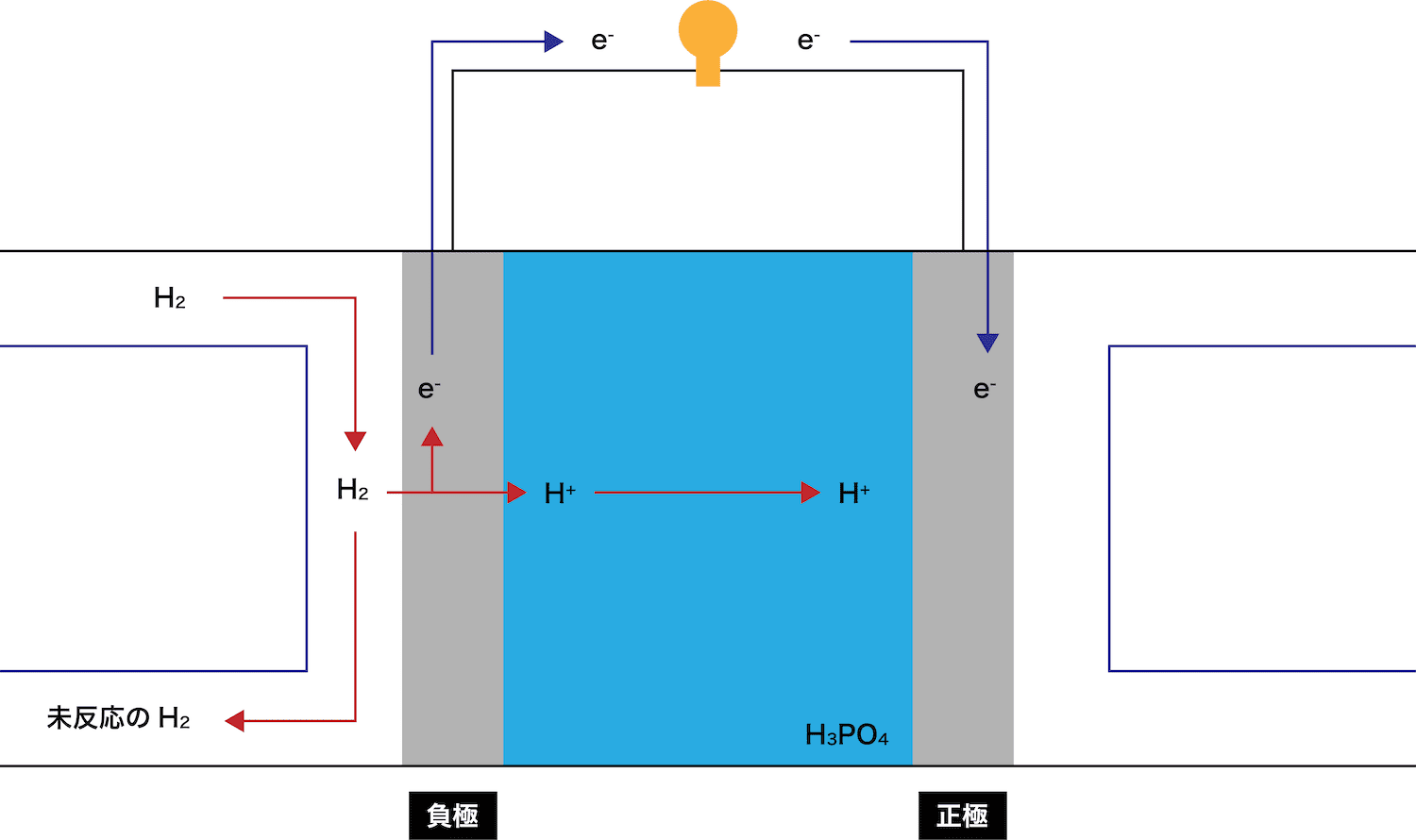

このとき、eーが通過することで(電流が発生して)豆電球が点灯していることに注目しよう。



余ったO2は外に排出される。
各極における反応
- リン酸型燃料電池の負極・正極での反応をまとめる。
負極
- リン酸型燃料電池の負極の反応式は次の通りである。
\[ \mathrm{H_{2} → 2H^{+} + 2e^{-}} \]
- 水溶液中のH2がeーを放出してH+となる。
正極
- リン酸型燃料電池の正極の反応式は次の通りである。
\[ \mathrm{O_{2} + 4H^{+} + 4e^{-} → 2H_{2}O} \]
- O2がH+とeーを受け取りH2Oとなる。
全体
- リン酸型燃料電池の負極と正極の反応式をまとめて、リン酸型燃料電池全体の反応式をつくる。
\[ \begin{array}{rr}
& \mathrm{H_{2} → 2H^{+} + 2e^{-} ×2}\\
+\big{)}&\mathrm{O_{2} + 4H^{+} + 4e^{-} → 2H_{2}O}\\
\hline
&\mathrm{2H_{2}+O_{2} → 2H_{2}O}
\end{array} \]
- これが、リン酸型燃料電池の全体式である。電子eーの数を合わせて消すために、負極の式を×2していることに注意しよう。
アルカリ型燃料電池
- 水酸化カリウムKOH水溶液を電解液とする燃料電池をアルカリ型燃料電池という。



- アルカリ型燃料電池は、アメリカのアポロ宇宙船に搭載されたことで有名である。
アルカリ型燃料電池の電池式
- 上述の通り、アルカリ型燃料電池は、水酸化カリウムKOH水溶液を電解液とする燃料電池である。
- これを踏まえて、アルカリ型燃料電池の電池式は次のように表すことができる。
\[ \mathrm{(-)H_{2}|KOHaq|O_{2}(+)} \]
- 各極の反応が少し複雑なので、負極と正極の反応を別々に確認し、その後まとめる形で解説する。
負極の反応
- アルカリ型燃料電池の負極の反応について、次の3STEPで解説する。
●STEP1
負極で、水素H2が電子eーを離して水素イオンH+となる。
●STEP2
放出されたeーとH+はそれぞれ正極側に伝わっていく。
●STEP3
KOHから電離したOHーがH+と反応し、H2Oが生成する。
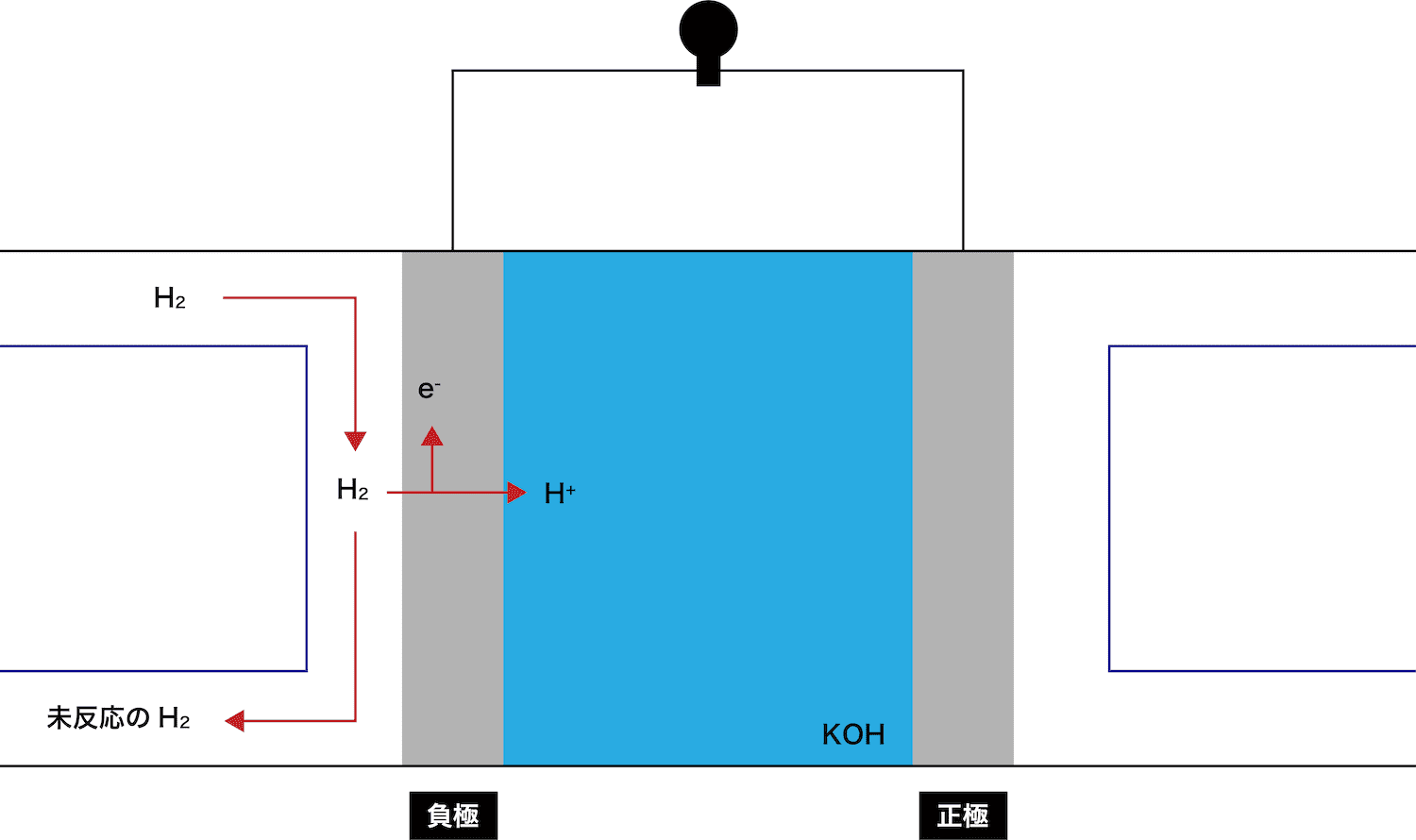

余ったH2は外に排出される。
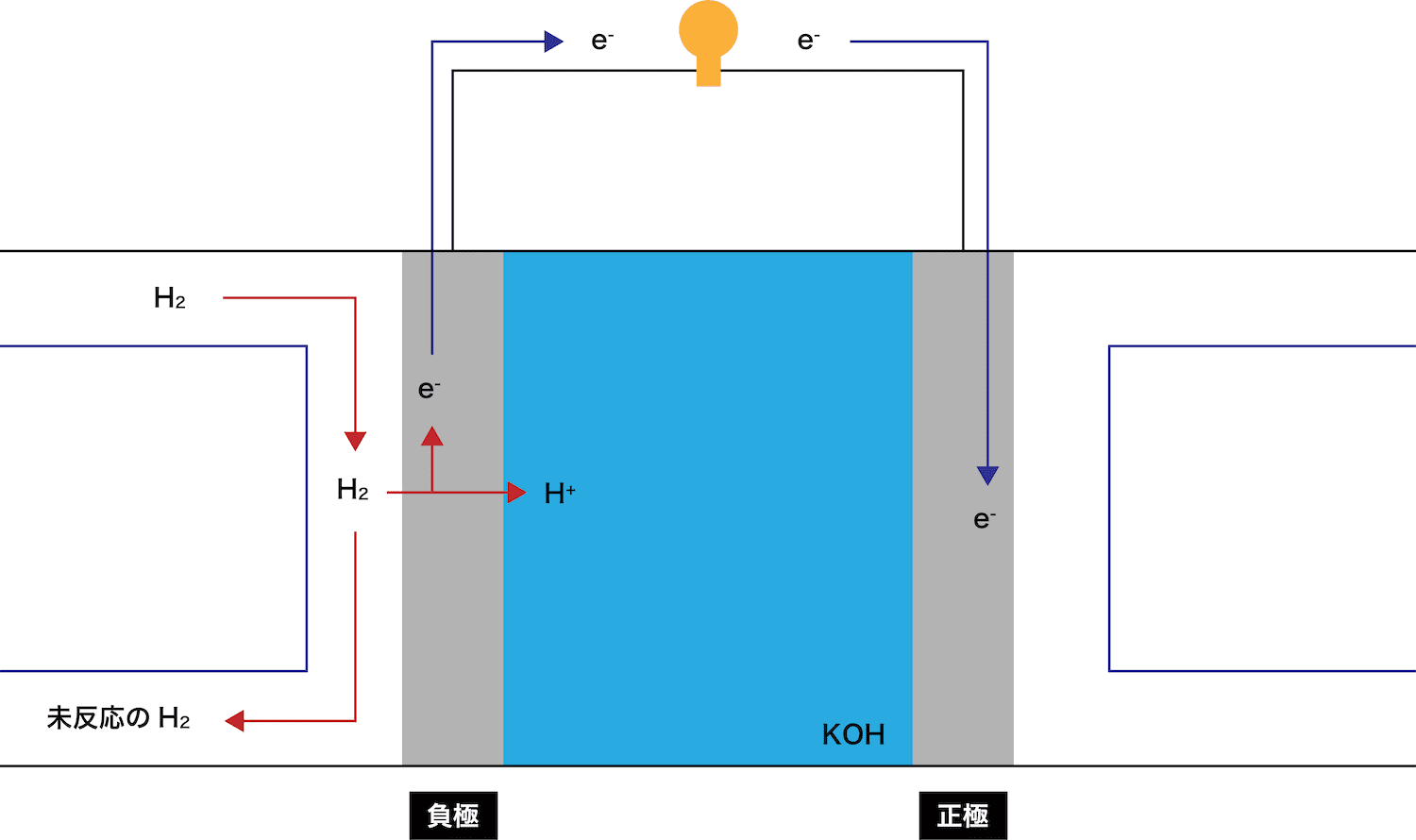

このとき、eーが通過することで(電流が発生して)豆電球が点灯していることに注目しよう。
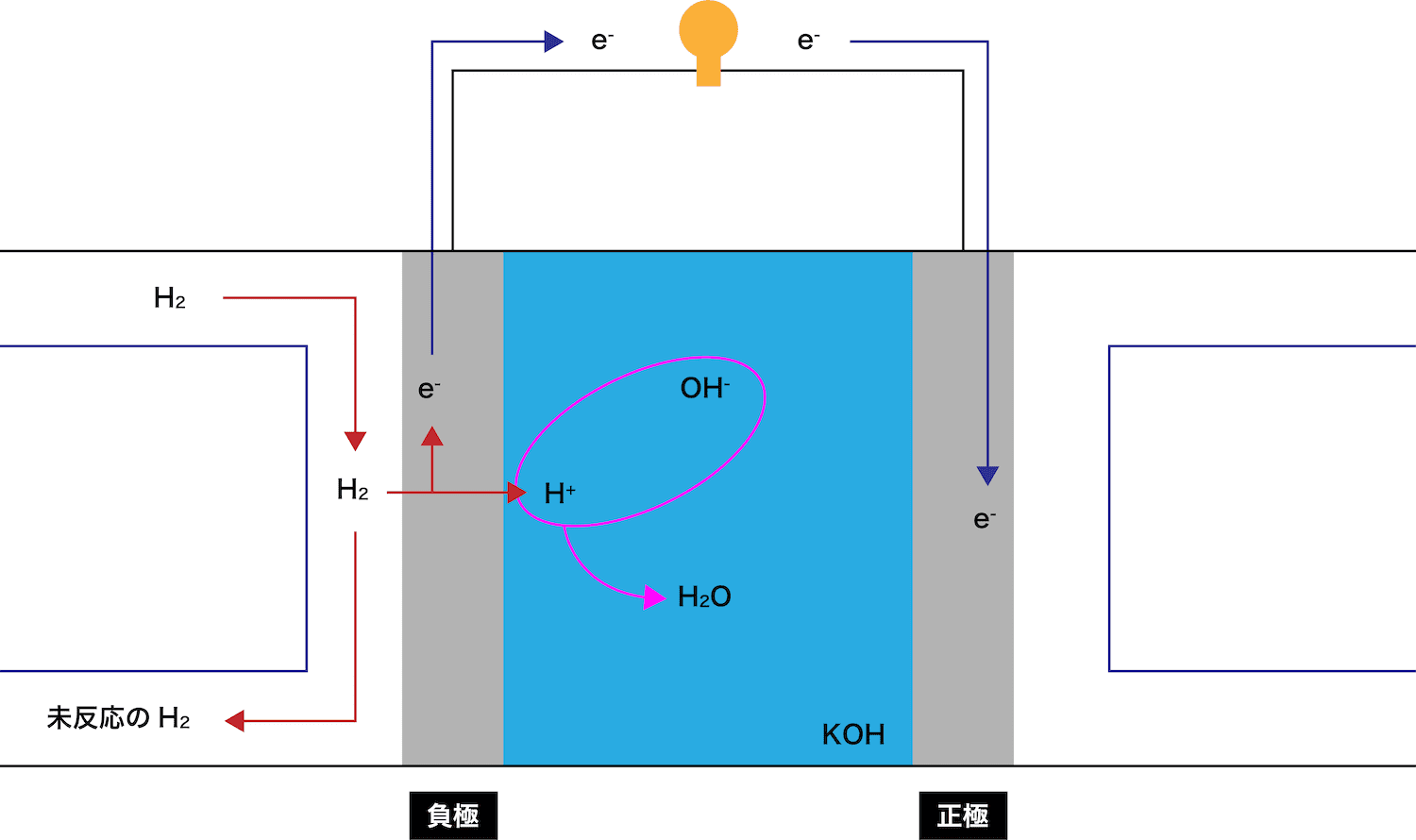

ちなみに、アルカリ型燃料電池の負極の反応式は、H2からH+が生成する式である
\[ \mathrm{H_{2} → 2H^{+} + 2e^{-}} \]
に、(溶液中に存在している)OHーを足し合わせれば良い。したがって…
\[ \begin{array}{rr}
& \mathrm{H_{2} → 2H^{+} + 2e^{-} }\\
+\big{)}&\mathrm{+ 2OH^{-} + 2OH^{-}}\\
\hline
&\mathrm{H_{2}+2OH^{-} → 2H_{2}O + 2e^{-}}
\end{array} \]
これがアルカリ型燃料電池の負極の反応式である。
また、生成したH2Oの一部は排出され、残りは電解液中に残される。
正極の反応
- 次に、アルカリ型燃料電池の正極で起こる反応を確認する。


- 負極から流れてきたeーと上の反応(H2+2OHー→2H2O+2eー)で発生して電解液中に取り残されていたH2Oが、正極から吹き込まれたO2と反応し、結果としてOHーが生成する。
- 以上を踏まえると、アルカリ型燃料電池の正極の反応式は、次のようになる。
\[ \mathrm{O_{2} + 2H_{2}O + 4e^{-} → 4OH^{-}} \]
アルカリ型燃料電池まとめ
- アルカリ型燃料電池について、上で解説したことをまとめると、次のようになる。



- 「真ん中でサイクルが出来ている」ということがポイントである。
- 正極で使うH2Oを負極が、負極で使うOHーを正極がつくり出している。このおかげで、燃料電池は連続的にエネルギーを生み出すことが可能になっている。
- 最後に、アルカリ型燃料電池の全体式をつくる。正極と負極の反応式をまとめると、次のようになる。
\[ \begin{array}{rr}
& \mathrm{H_{2} + 2OH^{-} → 2H_{2}O + 2e^{-} ×2} \\
+\big{)}&\mathrm{O_{2}+2H_{2}O+4e^{-}→4OH^{-}}\\
\hline
&\mathrm{2H_{2}+O_{2} → 2H_{2}O}
\end{array} \]











